前言
蛋白激酶几乎调节细胞生命的所有方面,其表达的改变或基因的突变会导致癌症和其他疾病。比如,经典的MAP激酶级联突变会导致癌症。从伊马替尼2001年上市开始,激酶抑制剂药物已经走过了20个年头。蛋白激酶能否作为药物靶点此前曾受到许多制药公司的怀疑。直到1998年伊马替尼进入临床试验改变了人们对蛋白激酶作为药物靶点的看法。从那时起,数百种蛋白激酶抑制剂被开发出来,并在人体上进行了测试,由此开启了靶向药物开发的时代。
最近,一篇发表在《Nature Reviews Drug Discovery》杂志上的综述总结了这20年激酶药物发展及治疗的现状,梳理了抗药性的原因和可能的解决方法。还预测了后20年这类药物发展的可能性。
2001年,个激酶抑制剂伊马替尼(格列卫)获得了FDA的批准。伊马替尼是首个通过针对特定蛋白激酶开发的药物。它是由瑞士诺华公司研制出的、也是人类个用于抗癌的分子靶向药。
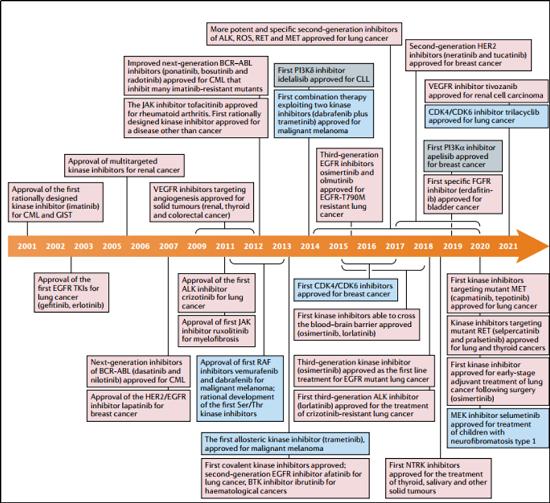
激酶抑制剂获批现状
哈佛医学院医学Pasi A. Jänne教授帮我们总结了自2001年伊马替尼获批以来,批准的76个激酶新药。
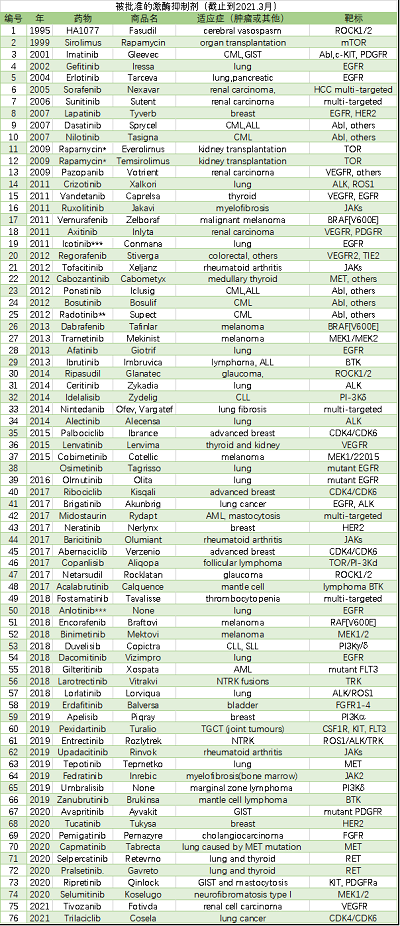
从目前药物使用来看,除了开发下一代抑制剂外,也开始通过靶向血管增生、PI3K通路来进行治疗探索,还通过跟上代药物或者不同靶点抑制剂、免疫疗法进行联用开发。目前,激酶抑制剂在一线疗法及辅助治疗范围取得了巨大成功。这些化合物对我们现在治疗癌症和非癌症疾病的方式已经产生了重大影响。比如,多个临床试验都表明,针对性的对基因型使用基因型导向治疗(针对EGFR突变和alk重排的NSCLC)可提高应答率和无生存期(PFS),并减少不良副作用。再比如,血脑屏障是治疗晚期肿瘤转移的一大障碍,一些新一代激酶抑制剂包括奥希替尼、阿乐替尼、布加替尼、氯拉替尼、司培卡替尼和卡马替尼已证明NSCLC患者的临床中枢神经系统活性。
激酶抑制剂药物普遍存在的耐药性
尽管批准的激酶抑制剂无疑给许多癌症患者带来了巨大的好处,但这些药物并不能治愈。大多数药物只能延缓肿瘤的进展,因为晚期肿瘤找到逃避途径来绕过靶标抑制,导致耐药性。对激酶抑制剂的耐药性可大致分为原发性耐药性和获得性耐药性。即使肿瘤存在与特定激酶抑制剂致敏相关的致癌驱动突变,也不是所有的肿瘤细胞都有反应,而其他细胞只表现出短暂的获益时间。这可能是由于肿瘤的外部因素,如药物对靶激酶产生的抑制不足或与激酶的关联时间不够长。
原发性的耐药。尽管在EGFR突变的NSCLC中存在致瘤依赖,但由于存在新生的MET扩增或EGFRT790M突变,一部分患者在使用早期EGFR抑制剂治疗时并没有实现肿瘤收缩,这介导了对这些药物的主要耐药性。类似的观察也出现在其他治疗环境中,包括使用激酶抑制剂的其他类型的癌症。增加对来自肿瘤组织和血浆的NGS数据的获取将继续是关键,并导致对肿瘤分子异质性的更深层次的理解。反过来,这将指导解决原发耐药性所需的策略,如联合疗法。
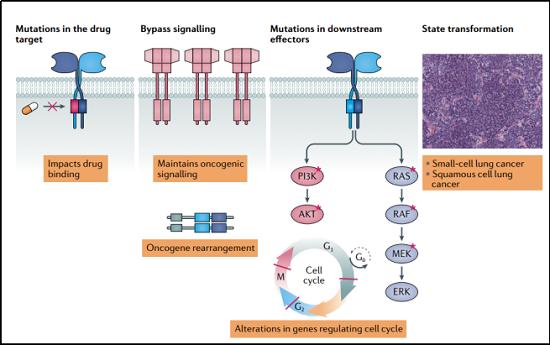
获得性耐药性。相对于原发性耐药,获得性耐药才是更应该引起研究者注意的。获得性耐药机制可由靶点蛋白再次突变、获得“旁路”信号通路或通过组织学转化引起。如果是肿瘤转移定植成新的肿瘤,则是由肿瘤微环境生物学的改变引起,或者是转移性肿瘤细胞通过寻找抑制剂无法进入的避难所(如中枢神经系统)而逃避抑制剂造成的。
肿瘤细胞对药物产生耐药性的一个普遍机制是通过增加药物转运体的表达和活性,例如多药耐药蛋白或脑癌耐药蛋白,它们积极地将药物从细胞中运出。这种机制也可能阻止激酶抑制药物在中枢神经系统内达到临床有效浓度,因为中枢神经系统中这些药物转运体有高水平表达。
值得一提的是获得性耐药性的第二个主要机制:癌细胞绕过靶向激酶。这可能发生在另一个激酶(或多个激酶)的过表达或扩增,然后模仿药物激酶的作用。例如,在非小细胞肺癌中,肿瘤细胞通常通过扩增编码MET的基因来对EGFR抑制剂产生反应。这些RTK会开启相同的下游信号通路。如果不受药物抑制,这些下游信号通路通常也会被突变的EGFR激活(即RAF-MEK-ERK和PI3K-PDK1-AKT通路)。在乳腺癌中,对靶向HER2过表达的药物的耐药性同样与转向替代RTKs(包括MET、HER3和IGF1R)有关。比如,在雌激素受体阳性乳腺癌中,对CDK4/CDK6抑制剂ribociclib(瑞博希尼)和palbociclib(帕博希尼)的耐药性是通过获得性上调CDK6及其激活因子cyclin D1,导致这些药物对CDK6的抑制效果较差。CDK2/cyclin E活性的上调是palbocicli耐药的另一个原因,它可以通过联合使用CDK2和CDK4/CDK6抑制剂来抑制。
如何破除耐药?
在过去的20年里,在了解获得性耐药性的机制和制定策略以延长患者的治疗受益时间方面取得了相当大的进展。
一个主要的方法是开发新一代药物,不仅具有增强选择性和减少副作用,而且能够处理由“看门人”和其他位点突变引起的靶标耐药。这种方法导致了在多种疾病环境中针对同一靶点的不同药物的连续批准。一个重要的例子,是一种EGFR抑制剂,用于治疗由EGFR激酶结构域“看门人”位点T790M突变引起的吉非替尼(gefitinib)和埃洛替尼(erlotinib)的靶向耐药性。
最初,第二代抑制剂afatinib(阿法替尼)和dacomitinib(达克替尼)的设计目的是增强效力,并试图克服代抑制剂的耐药限制。尽管这些化合物已被批准用于临床,但它们的一个关键缺点是对野生型EGFR活性增加,这加剧了常见的副作用,如皮疹和腹泻。由于这些副作用限制了大多数患者的剂量,因此不可能在临床环境中使用这些化合物的浓度来有效处理T790M突变。这一挑战促使几家公司采取创新策略,开发专门针对EGFR-T790M突变体的第三代抑制剂,同时保持对初始激活突变的活性,并对野生型EGFR保持足够的选择性,以解决afatinib(阿法替尼)和dacomitinib(达克替尼)的局限性。于是,个第三代EGFR抑制剂osimertinib(奥希替尼)被开发和批准。
与化疗相比,奥希替尼不仅改善了EGFR-T790M人群的PFS,而且与代抑制剂吉非替尼和厄洛替尼相比,在EGFR突变的一线治疗中也改善了PFS。因此,奥希替尼已成为治疗的标准,目前被用作EGFR突变NSCLC的一线治疗,使所有患者都能受益于生存期的改善,无论他们是否携带EGFRT790M突变。然而,尽管奥希替尼有效,癌细胞仍然发现获得性耐药性的其他途径来逃脱奥希替尼的抑制,包括EGFRC797S突变,这阻止了奥希替尼与EGFR共价结合,或通过MET的扩增绕过EGFR产生耐药机制。因此,需要针对新的突变进行药物设计和筛选出下一代的抑制剂。
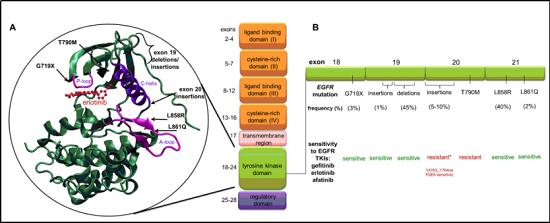
另外,也可以通过开发新的突变或者绕过途径通路中的靶点来开发新的药物。如果能很清楚的知道耐药性质,利用已有的药物进行联用也是一个比较好的选择。
激酶药物发现的未来
激酶药物现在的适应症已经扩展到平滑肌松弛和免疫抑制、炎症和自身免疫性疾病、阿尔茨海默病、帕金森病以及其他由激活蛋白激酶突变引起的疾病。尽管人类基因组编码的500种蛋白激酶中只有50种被用于癌症的治疗,但Pasi A. Jänne教授仍然认为在未来20年,肿瘤将继续主导激酶药物的发现领域。而且他和团队还预测,未来抗癌药物开发中靶向的新激酶的数量只会小幅增加。原因是近年来,驱动特定癌症的激酶的新突变还没有被发现。
肿瘤基质微环境和免疫生物学在癌细胞保护中的作用将是一个重点研究领域。主要关注于确定和开发可以靶向类似于TAM (TYRO3, TYRO3和MER)和 CSF1R的激酶小分子抑制剂。这些激酶在免疫信号传递中起关键作用,它们可能补充或取代生物药物的免疫肿瘤学方法。
蛋白质激酶抑制剂抗体相关开发也是一个热门领域。靶向RTK或其激活配体的抗体已获批准多年,例如用于HER2阳性乳腺癌患者的抗HER2抗体曲妥珠单抗(herceptin)和用于实体肿瘤治疗的抗VEGF抗体贝伐单抗(Avastin)。那么下一代抗体方法将导致更多药物获得批准,其中将包括双特异性抗体,可以阻断不止一个激酶。Amivantamab (JNJ-61186372)是一种由强生开发的MET/EGFR双抗,在临床开发中已经显示出令人鼓舞的数据。国内也有很多公司也开发了相似的产品。去年年底,强生已经向FDA以及EMA提交了上市申请,并于今年5月21日获批上市。抗体药物偶联(ADC)是另一个令人兴奋的未来治疗平台,特定的抗体与细胞毒素相连接。随着抗HER2 ADC的批准,临床概念的证明已经实现,例如用于乳腺癌的恩美曲妥珠单抗(T-DM1)和Enhertu(DS8201),是曲妥珠单抗分别连接emtansine (一种细胞毒微管抑制剂)和deruxtecan (一种拓扑异构酶1抑制剂)。
参考出处
1. Kinase drug discovery 20 years after imatinib: progress and future directions.
2. Epidermal growth factor receptor (EGFR) mutations in lung cancer: preclinical and clinical data.
