概述【1】【2】
富马酸比索洛尔(康析,Bisoprolol Fumarate)是一种具有高选择性的长效β受体阻滞剂,它兼有亲脂性受体阻滞剂吸收快和亲水性受体阻滞剂半衰期长、首过效应低的优点,临床上用于治疗高血压、心绞痛、心律不齐等疾病。
理化性质【1】
本品为白色粉末,无臭,在水中极易溶解,乙醇中易溶,丙酮中微溶,乙醚中不溶。
药效学【3】
β选择性:由放射配基一受体结合分析表明,BSP为高选择性β1受体拮抗剂,对β1受体亲合力比对β2受体强100倍。阻滞β1受体的作用较普蔡洛尔强5-10倍,试验表明预先给予BSP可以消除异丙肾上腺素增加肾素水平的作用,由于异丙肾上腺素是非选择性β受体激动剂,有人认为其肾素水平增加是由于激动几受体,血管扩张,血压降低而使交感神经反射性兴奋的结果。因为激动β2受体的直接效应是使血管扩张,导致肾素水平下降,与异丙肾上腺素增加肾素水平的现象矛盾;此外选择性β1阻滞剂阿替洛尔等能降低肾素水平也支持本观点倾向。BSP降低肾素水平认为也是阻断β1受体的表现,有待进一步考证。
富马酸比索洛尔对血管和血压的影响:国外报道BSP有拮抗α受体递质收缩血管的作用。由于选择性阻断β1受体而降低肾素水平,使外周阻力下降,BSP的降压作用是肯定的。但有人观察到一次给药可减少心率,降低收缩压,却不能显著影响舒张压。因此BSP长期给药才能降低外周阻力,降压作用主要是通过阻断心肌β1受体减少心输出量及阻断肾小球旁器细胞β1受体来降低肾素水平。
对心肌的保护作用:BSP能减慢心率降低血压,从而降低心率和血压乘积而降低心肌耗氧,且不干扰脂质代谢,作用较普蔡洛尔、美托洛尔强,是抗心绞痛的理想药,国内外均有资料表明BSP可改善左室壁肌的扩张,而对心室收缩力影响小,认为其虽有负性频率作用,却无明显的负性心力作用,对血流动力学影响是安全的,可用于充血性心衰。
对心肌电生理的影响:BSP选择性阻断β1受体而有明显的负性频率作用,可用于室上性心动过速的治疗。国内有人以电生理检查发现给药后窦性周期、不应期延长,但都在正常范围内。故认为在治疗剂量下膜稳定作用极弱,一般不造成传导阻滞的副作用。
富马酸比索洛尔无内源性拟交感活性:文献报道治疗剂量的BSP不增加气道阻力,不降低1秒钟呼气量(FEV1),对吸人沙丁胺醇无影响,说明无拟交感活性。根据受体调节理论,当受体受到拮抗剂作用时,受体数目上调。这种现象也可以支持BSP专一性阻断作用而无内在拟交感活性。
富马酸比索洛尔对肾功能的影响:一次静注BSP后对肾功能的影响有多种观点。西安有生医药研究所认为:与阿替洛尔、普蔡洛尔比较,BSP是唯一能降低肾血管阻力,增加肾血流量的药物给药后出现肾小球滤过率降低,有效肾血流量及对氨马尿酸清除率降低,并认为与普蔡洛尔、阿替洛尔相似;BSP选择性阻断β1受体,不会出现如普蔡洛尔样的外周阻力增加,肾血流量减少等非选择性阻断的现象,有待实验证明。
富马酸比索洛尔对代谢无影响:文献报道认为无论是动物模型还是人体试验均未见明显的代谢变化,较普蔡洛尔更适合于心绞痛患者;且对胰腺β受体抑制作用弱,尤其适合于糖尿病合并高血压或心绞痛患者。
药动学【3】
BSP亲脂性和亲水性相等,脂水分配系数接近1,口服易吸收,不受食物、年龄、性别的影响,达峰时间约1.5-3h。表观分布容积226±11L,说明体内分布广泛,但动物实验表明较少通过胎盘。与血浆蛋白结合率仅30%。故作用强烈,较少与其它药物发生相互作用。与美托洛尔、普蔡洛尔相比水溶性较高,较少通过血脑屏障,外周选择性高。BSP有两条等量消除途径:50%经肾以原形排泄;50%经肝代谢。由于其亲脂性较其它洛尔类药物低,肝摄取率低,首过效应小,血药浓度高,口服后Cmax可达静注的85%。半衰期长,达10-12h,可每天服药1-2次。
国外对兴奋和静息两种状态下BSP的代谢动力学进行了研究。结果表明在兴奋状态下AUC减少极限为8%,正常清除率增加却不伴随其它药动学特征的显著改变。提示兴奋不减少药物的吸收,总清除率增加是由于肝清除率增加的结果。另有报道兴奋时虽然儿茶酚胺水平上升,但对肝血管作用则是扩张,肝血流量增加,使肝清除率增加。本文认为肝清除率增加还与兴奋状态下机体的应激水平使肝药酶活性升高有关。
毒理学【3】
急性毒性试验表明:小鼠口服LD50±95%可信限给药量为1263±193mg/kg,临床给药按60kg,5mg/d,相当于0.083mg/kg,小鼠口服LD50是人用剂量的14000倍,安全可靠。慢性毒性试验用大鼠200mg/kg连服90d观察,未见死亡和蓄积,6项血液学指标和12项生化指标无异常。未见致畸、致突变报道。
制备方法【1】
以4-羟基苯甲醇为原料的合成路线
该路线以4-羟基苯甲醇为原料与2-异丙氧基乙醇在150℃高温下进行醚化,再依次与环氧氯丙烷、异丙胺及富马酸成盐四步合成目标产物。
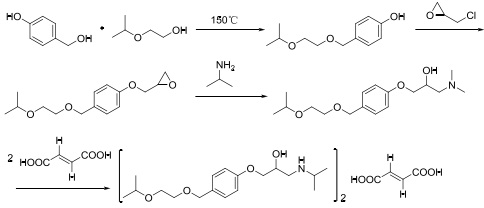
图1为4-羟基苯甲醇为原料的合成路线
目前,工业上主要以该路线合成富马酸比索洛尔,然而,该路线中的步反应需要在150℃的高温下进行,此高温下,原料会发生自身缩合反应生成二聚体或多聚体杂质,降低了收率和粗品的纯度,并且此温度在工业上很难达到。
2.以4-异丙氧基乙氧基甲基酚为原料的合成路线
用4-异丙氧基乙氧基甲基酚(CAS号:177034-57-0)为原料,相转移催化剂的作用下,与1,3-二氯二羟基丙烷进行酚羟基醚化、再与异丙胺在高温高压下胺解生成比索洛尔,如图2所示。
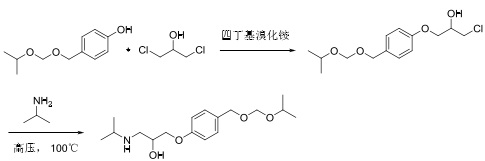
图2为以4-异丙氧基乙氧基甲基酚为原料合成路线
该方法工艺简单,易于操作,但是原料4-异丙氧基乙氧基甲基酚的来源少,价格昂贵,不易制得,第二步反应在高温、高压下进行,设备要求高,生产成本高,不适合工业化生产。
3.以4-甲基苯酚为原料的合成路线
以4-甲基苯酚为原料,经羟基保护、溴代、取代、水解、酸化、酚羟基醚化、胺解、成盐反应生成目标产物,如图3所示。
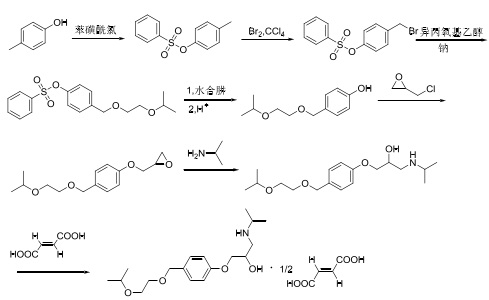
图3为4-甲基苯酚为原料的合成路线
该路线使用苯磺酰氯将酚羟基进行保护,有效的减少了杂质的生成,然而,溴素作为溴代试剂,溴素具有剧毒,而且容易发生多溴代引入新的杂质,且路线较长,收率低,不适合工业化生产。
4.以3-(异丙基氨基)-1,2丙烷二醇为原料的合成路线
以3-(异丙基氨基)-1,2丙烷二醇为原料,经与碳酸二甲酯成环、对甲苯磺酰氯酰化、4-羟基苯甲醛偶合、硼氢化钠还原、成醚、开环及成盐7步反应制得目标产物。如图4所示。
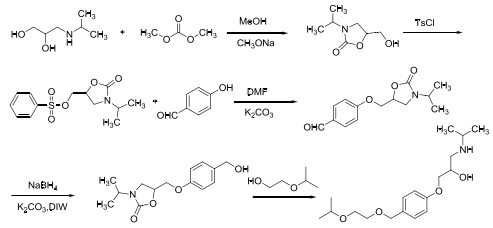
图4为3-(异丙基氨基)-1,2 丙烷二醇为原料的合成路线
该路线具有中间体均为固体的优势,便于分离提纯,但原料3-(异丙基氨基)-1,2丙烷二醇的来源较少,制备困难,并且反应收率低。由于路线较长导致产物的纯度和产率低。该方法的实际生产意义不大,但可以作为实验室制备目标产物的方法。
5.以4-羟基苯甲醛为原料的合成路线
以4-羟基苯甲醛为原料,经硼氢化钠还原、醇羟基醚化、酚羟基醚化、胺解、富马酸成盐合成目标产物。如图5所示。
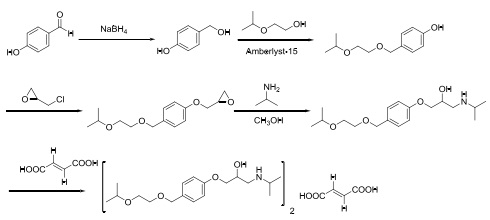
图5为4-羟基苯甲醛为原料
该路线以常见易得的4-羟基苯甲醛为原料,具有初始原料成本低的优势,但是使用了酸性离子交换树脂型催化剂,用量大,同样需要对催化剂进行再激活,操作繁琐。2-异丙氧基乙醇和异丙胺用量极大,不易于回收利用,生产成本高,产生的工业废渣多,这种工艺不适合工业化生产。后处理过程中使用大量的甲苯,不利于操作人员的身体健康。
应用【1】
富马酸比索洛尔临床上用于治疗高血压、心绞痛、心律不齐等疾病。
主要参考资料
[1]马志佳. 富马酸比索洛尔的合成工艺研究[D].济南大学,2016.
[2]郑艳. Ⅰ.富马酸比索洛尔的合成研究 Ⅱ.几类抗炎抑制剂的定量构效关系研究[D].北京化工大学,2007.
[3]陈鸳颖,刘锡钧,郑沁鈊.富马酸比索洛尔临床前药理研究进展[J].海峡药学,1999(04):1-2.
