背景及概述【1】
匹伐他汀钙化学名为(3R,5S,6E)-7-[2-环丙基-4-(4-氟苯基)-3-喹啉基]-3,5-二羟基-6-庚烯酸钙,系日本化学工业株式会社与兴和株式会社共同开发的第三代他汀类药物, 于2003年7月在日本注册上市, 通用名为 Pitavastatin Calcium,在临床试验中以其强大的降脂效力被誉为 “超级他汀”。
匹伐他汀钙的作用机制【2】
匹伐他汀钙中间体的作用机制目前认为是抑制细胞内胆固醇合成早期阶段的限速酶,即HMG-COA 还原酶,使细胞内游离胆固醇减少,继而反馈性上迢细胞表面低密度脂蛋白(LDL)受体的表达,使细胞 LDL 受体数目增多及活性增强,加速了循环血液中极低密度脂蛋白(VLDL)残粒或中密度脂蛋白(IDL)和 LDL 的清除。此外,它还可抑制肝内 VLDL 的合成,其降低总胆固醇(TC)和 LDL-C的作用较为明显,同时也降低三酰甘油(TG)和升高高密度脂蛋白胆固醇(HDL-C)。
匹伐他汀钙的毒理学【2】
在小鼠、大鼠和犬的一般药理研究中表明,匹伐他汀钙没有明显的急性毒副作用。3~30mg/kg匹伐他汀钙对总体行为、自发运动活性、环己巴比妥诱导的麻醉效应、电休克性惊厥均没有明显影响,该药10~30mg/kg抑制醋酸诱导小鼠的扭体反应,但对夹尾反应没有影响。在离体豚鼠回肠实验中,100umol/L 匹伐他汀钙可明显抑制乙酰胆碱、组织胺和氯化钡诱导的肠痉挛。而该药0.3~3mg/kg 静脉注射对麻醉犬的呼吸、血压、心率、心电图、股动脉血流、乙酰胆碱诱导的减压反射或去甲肾上腺素诱导的升压反射均没有影响。匹伐他汀钙对小鼠肠推进、大鼠胃和胆汁分泌以及豚鼠的结石形成指数也都没有影响,对血小板聚集也无促进作用。
以2,10,50,100mg/kg 四个剂量给大鼠口服匹伐他汀钙,连续给药28d ,恢复2周,结果表明其无毒剂量为2mg/kg。而在长期毒性实验中,大鼠分0.3,1,10mg/kg四个剂量口服匹伐他汀钙,连用6个月,恢复1月,结果显示其无毒剂量为1mg/kg。
以细菌回复突变试验、染色体畸变试验及小鼠微核试验评价匹伐他汀钙的致突变作用的研究结果显示,匹伐他汀钙无体内致突变作用。
匹伐他汀钙中间体的药理【2】
匹伐他汀钙的药理如下:(1)抑制HMG-CoA还原酶 匹伐他汀钙对HMG-Co A酶有强力拮抗性抑制作用,IC50值为6.8n M,其作用强度是辛伐他汀的2.4倍,是氟伐他汀的6.8倍。(2)阻碍胆固醇的合成匹伐他汀钙能够高效抑制人肝细胞Hep G2 中生成胆固醇的过程,IC50值5.8nM ,其作用强度是辛伐他汀的2.9倍,是阿伐他汀的5.7 倍。但是匹伐他汀钙对甲羟戊酸生成后胆固醇生成过程中各酶的抑制作用非常弱。(3)增大LDL受体密度匹伐他汀钙能在1μM的超低浓度下诱导LDS受体mRNA的合成,使其数量增加,导致LDL受体密度增大,从而促进LDL的清除,使血浆LDL-胆固醇浓度及血浆总甘油三酸酯浓度降低。
匹伐他汀钙中间体的制备【2】
(3R,5S)-7-[2-环丙基-4-(4-氟苯基)-3-喹啉基]-3,5-二)-3,5-二羟基-6-氧代-3,5-O-亚异丙基己酸叔丁酯 (1) 是合成匹伐他汀钙重要的中间体, 文献报道主要有两条途径: 一是以非手性化合物为起始原料, 合成混旋体后再进行拆分; 二是以手性化合物为起始原料, 或经手性诱导产生手性, 再经选择性还原合成目的产物。 其中文献报道的以手性原料合成主要有以下 4 种方法。
方法一: 以(S)-3-羟基-4-卤代丁酸酯为起始原料, 经缩合反应得到 β-羰基酯, 然后微生物催化下得到顺式二羟基化合物, 再经过缩酮保护、 取代、选择性水解得到(3R,5S)-3,5,6-三羟基-3,5-O-亚异丙基己酸叔丁酯 (1), 手性诱导合成中使用了微生物,虽然手性选择性好, 但是微生物的选择和反应控制较为困难、 繁琐。
方法二: 以 D-(-)酒石酸二异丙酯为原料,经硅烷基保护后依次进行缩合、DIBALH还原、立体选择性还原缩酮保护、 脱硅烷基保护,最后高碘酸钠氧化得到(3R,5S)-3,5-二羟基-6-氧代-3,5-O-亚异丙基己酸叔丁酯 (1), 其中硅烷基的脱除需要用到四丁基氟化铵 (TBAF), 对玻璃具有腐蚀性, 总收率只有15.8%。
方法三: 以手性氯代丙二醇为起始原料 ,经氰基取代、 苄基保护、缩合、 立体选择性还原、缩酮保护、脱苄得到(3R,5S)-3,5-二羟基-6-氧代-3,5-0-亚异丙基己酸叔丁酯(1), 路线中需用到剧毒物氢化钾, 在选择性对伯羟基进行苄基保护时条件较为苛刻,选择性较差, 这将直接影响到整条路线的收率。
方法四: 以 L-(-)-苹果酸为原料,经甲酯化后用硼烷-甲硫醚溶液和催化量的硼氢化钠还原一个酯基, 三苯甲基保护羟基, 水解、 经缩合反应得 β-羰基酯,再经还原、TBDPS-Cl选择性保护羟基、三氟乙酸脱三苯甲基、PCC氧化得单一异构体(3R,5S)-3,5-二羟基-6-氧代-3,5-O-亚异丙基己酸叔丁酯 (1), 总收率 17.8%。
在参考方法四的基础上进行了部分改进,收率从文献的17.8% 提高到21.2%,并简化了实验操作,降低了反应成本 ,更适合工业化生产。
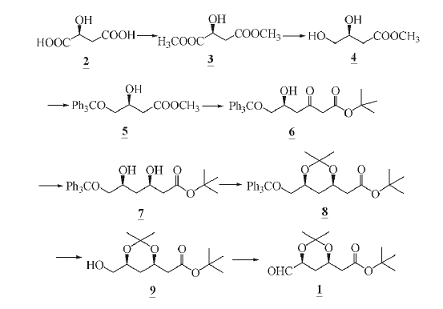
采用L-(-) 苹果酸(2) 为起始原料, 甲酯化后用硼烷选择性还原一个酯基得到化合物 4, 用三苯甲基保护4中的伯羟基制得化合物 5, 再和醋酸叔 丁酯经Claisen 酯缩合得到β-羰基酯(6), 在三乙基硼作用下 6 中的 3 位羰基被立体还原成羟基, 再以 2,2-二甲氧基丙烷将化合物 7 中的两个羟基做成缩酮(8),常压氢化脱三苯甲基保护得到化合物 9,最后用Swern 氧化法氧化6 位羟基得到 (3R,5S)-3,5- 二羟基-6-氧代-3,5-O-亚异丙基己酸叔丁酯(1),总收率 21.2%。 优化了反应条件, 操作简便, 收率提高,适合于工业化生产,合成路线见下图。
主要参考文献
[1] 单继雷,汤旗,李志裕,倪春峰,李睿婷,侯仲轲.匹伐他汀钙中间体的合成工艺改进[J].精细化工中间体,2008(05):27-29.
[2] 李巧. 匹伐他汀钙的合成与表征[D].重庆大学,2009.
