二十二碳六烯酸列入备案保健食品原料目录
2021年12月20日,市场监管总局关于公开征求《保健食品原料目录 营养素补充剂(2022年版)(征求意见稿)》《允许保健食品声称的保健功能目录 营养素补充剂(2022年版)(征求意见稿)》和《保健食品原料目录 蛋白质(征求意见稿)》意见的公告,拟将发酵来源的二十二碳六烯酸油脂列入备案保健食品原料目录。意见建议反馈截止时间为2022年1月19日。
继β-胡萝卜素以后,嘉必优将有另外一种原料进入备案保健食品原料目录。
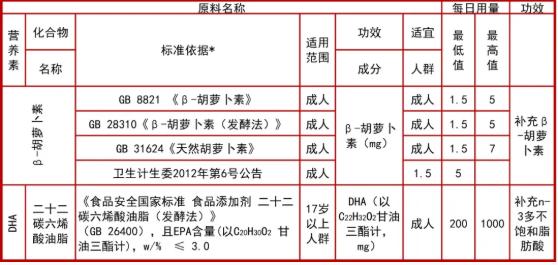
DHA:可备案剂型为软胶囊。仅可单原料用于产品配方,不得与其他原料复配。
DHA纳入原料目录的情况
(一)保健功能确定依据
根据现有的国内外科学共识,DHA是大脑细胞膜的重要构成成分,具有参与脑细胞的形成和发育等重要作用。此次在确定该原料的保健功能时,委托了中国营养学会对于该原料功能表述进行了研究,经过我中心组织的专题研讨,最终确定了DHA的保健功能为“补充n-3多不饱和脂肪酸”,理由为包括DHA在内的n-3多不饱和脂肪酸,根据现有的科学共识认为其不仅在大脑的发育中起到重要作用,还在血脂、血压调节等多方面发挥重要的作用。因此DHA作为人体需要的营养物质,保健功能以“补充”较为确切和科学。
(三)每日用量的确定
目前已批准的产品中DHA每日用量集中在每日200-600mg。根据中国膳食营养素参考摄入量(即成年人和老年人DHA+EPA的宏量营养素可接受范围(AMDR)为250-2000 mg/d),以及中国营养与健康调查,我国居民对此类营养素的摄入量普遍不足(EPA +DHA 摄入量约20 mg/d)。结合国外对于保健食品类似产品使用量规定,经专家研讨,最终确定此次DHA纳入保健食品原料目录的每日推荐量为200-1000mg。
(四)使用人群的确定
考虑到保健食品注册产品对于适宜人群和不适宜人群的审评研判,此次纳入原料目录的适宜人群确定为成人,不适宜人群包括17岁以下,孕妇,乳母。
(五)DHA原料技术要求确定依据
根据原卫生部《关于批准DHA藻油、棉籽低聚糖等7种物品为新资源食品及其他相关规定的公告(2010年第3号)》,DHA原料来源于裂壶藻(Schizochytriumsp.),或吾肯氏壶藻(Ulkenia amoeboida),或寇氏隐甲藻(Crypthecodinium cohnii)经过生物发酵、分离、提纯、脱臭、过滤等工艺制得。此外目前DHA的标准还有《食品安全国家标准 食品添加剂 二十二碳六烯酸油脂(发酵法)》(GB 26400-2011)、LS/T 3243-2015《DHA藻油》。经过整合上述标准,以及原料目录包的研究结果、原料生产企业检测,DHA原料在符合GB 26400-2011基础上,还应该将EPA含量作为重要质量控制指标。
(六)备案产品的原料和剂型要求
DHA藻油为油状液体,且已批准的单方产品剂型均为软胶囊,故将软胶囊列入可备案剂型,产品备案时也仅允许单方原料进行备案,不得与其他原料复配。
(七)备案产品的产品名称
DHA属于n-3多不饱和脂肪酸中的一种来源,目前仅将DHA拟纳入原料目录的n-3多不饱和脂肪酸,由于DHA目前仅为单方备案,产品备案时的通用名为“DHA”。
——以上信息来源国家市场监管总局
