背景及概述[1][2]
保特佐米又称硼替佐米,硼替佐米(Bortezomib),是由美国Millennium制药公司研发的新型抗肿瘤药物。该药是26S蛋白酶体抑制剂,通过阻断细胞内多种调控细胞凋亡及信 号传导的蛋白质的降解,导致肿瘤细胞死亡。大量研究发现,硼替佐米对多种肿瘤,尤其是 血液肿瘤中的多发性骨髓瘤、套细胞型淋巴瘤及其他B细胞类型淋巴瘤(弥漫大B细胞型、滤泡细胞型、小淋巴细胞型/慢性淋巴细胞白血病、边缘区淋巴瘤)、霍奇金淋巴瘤有较强的抗 肿瘤活性。
制备[1]
CN1960996A公开了N-(2-吡嗪羰基)-L-苯丙氨酸与(1S,2S,3R,5S)-蒎烷二醇1-三 氟醋酸铵-3-甲基丁烷-1-硼酸盐缩合制备硼替佐米前体,之后经过脱保护、精制等步骤得 到硼替佐米,合成路线如下:
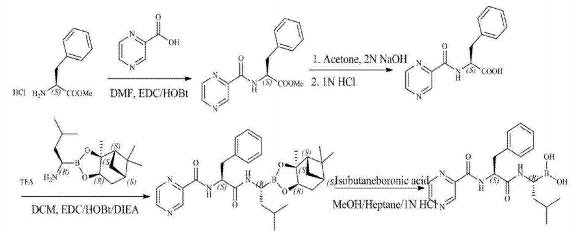
CN101812026A公开了以3-甲基丁醛和R-(+)-1-苯乙胺为起始原料,通过缩合、选 择性硼酸酯加成、氢化脱保护、与L-苯丙氨酸衍生物缩合、脱保护等得到硼替佐米,合成路线如下:
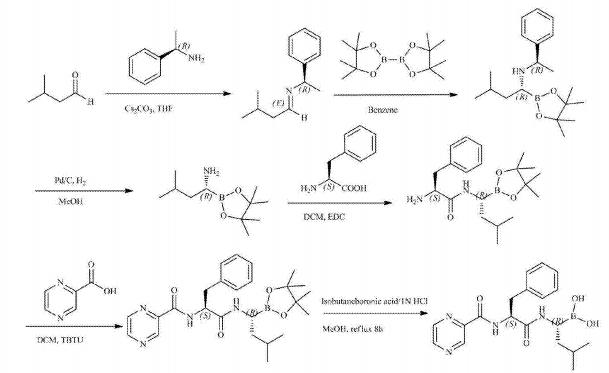
药理作用[2]
硼替佐米是哺乳动物细胞中26S蛋白酶体糜蛋白酶样活性的可逆抑制剂。26S蛋白酶体是一种大的蛋白质复合体,可降解被泛素化的蛋白质。泛素蛋白酶体通道在调节特异蛋白在细胞内的浓度中起到重要作用,以维持细胞内环境的稳定。蛋白水解会影响细胞内多级信号串联,这种对正常细胞内环境的破坏会导致细胞的死亡。而对26S蛋白酶体的抑制可防止特异蛋白的水解。体外试验证明硼替佐米对多种类型的癌细胞具有细胞毒性。临床前肿瘤模型体内试验证明硼替佐米能够延迟包括多发性骨髓瘤在内的肿瘤生长。
毒理研究
尚未进行硼替佐米的致癌性研究。用中国仓鼠卵巢细胞进行体外染色体畸变分析显示硼替佐米有诱裂活性 (染色体结构畸变)。体外诱变性分析 (埃姆斯试验) 和小鼠体内小核分析结果显示硼替佐米没有基因毒性。尚未对生育影响进行研究,但是在一般毒理学研究中对生殖组织进行了评价。6个月的大鼠毒理研究显示,剂量≥0.3mg/m2 (临床推荐剂量的1/4) 时发现对卵巢有变性的作用,剂量为1.2mg/m2时发现有变性的改变。本品可能对男性或女性的生育能力有潜在影响。
药代动力学[2]
对8名多发性骨髓瘤患者静脉给予本品1.3mg/m2,血药浓度中值为509ng/mL (范围109-1300ng/mL) ,肌酐清除率为31-169mL/min。对晚期恶性肿瘤患者给予本品1.45-2.00mg/m2,首剂量后的平均消除半衰期为9-15小时。作为单药,推荐剂量的硼替佐米在多发性骨髓瘤患者体内的药代动力学尚不完全明确。分布尚未对推荐剂量的硼替佐米在多发性骨髓瘤患者体内的分布容积进行研究。浓度为100-1000ng/mL时,硼替佐米与人体血浆蛋白的平均结合率为83%。代谢利用人体肝微粒体和互补脱氧核糖核酸(cDNA)表达的细胞色素P450同工酶进行的体外研究显示,硼替佐米主要通过细胞色素P450酶系的3A4、2C19和1A2酶氧化代谢,少量经2D6和2C9代谢。主要代谢途径是去硼酸化,形成2个去硼酸化代谢物,再通过羟基化形成几个代谢产物。去硼酸化的硼替佐米代谢产物无抑制26S蛋白酶体的活性。
8名患者给药后10-30分钟的血浆数据显示,血浆中代谢产物的浓度比原形药物低。消除尚未对硼替佐米在人体内的消除途径进行研究。特殊人群 年龄、性别和人种:尚未就年龄、性别和人种对硼替佐米药代动力学影响进行评价。 肝功能损害的患者:尚未进行对肝功能损害患者的药代动力学研究。 肾功能损害的患者:在一项药代动力学研究中,不同程度的肾功能损害患者按肌肝清除 率 (CrCL) 分组:正常 (CrCL≥60mL/分钟/1.73 m2,n=12),轻度 (CrCL=40-59mL/分钟/1.73m2,n=10),中度 (CrCL=20-39mL/分钟/1.73 m2,n=9) 和重度 (CrCL<20mL/分钟/1.73 m2,n=3)。本研究包括需透析且在透析结束后再给予本品的患者8例。本品静脉的剂量为0.7~1.3mg/ m2,每周2次。本品的暴露量 (剂量一标准化AUC和Cmax)在各组中有可比性。
临床应用和适应症[2]
本品用于多发性骨髓瘤患者的治疗,此患者在使用本品前至少接受过两种治疗,并在最近一次治疗中病情还在进展。本品的有效性基于它的有效率。尚无临床对照试验证明其临床利益,如对存活率的改善。
不良反应[2]
治疗复发/难治性多发性骨髓瘤患者的临床试验总结在三项临床研究中评价了本品在推荐剂量1.3mg/ m2下的疗效和安全性,包括一项随机的地塞米松对照3期试验 (M34101-039),治疗669例1-3线治疗后复发或难治性多发性骨髓瘤患者;一项单臂、开放性、多中心的2期试验,治疗202例曾接受过2线治疗且近期发现病情恶化的患者 (M34100-025);一项评价本品剂量-反应的2期临床试验,治疗病情恶化或复发或接受过本品1.0mg/m2或1.3mg/m21线治疗的复发性多发性骨髓瘤患者 (M34100-024)。
本品在套细胞淋巴瘤患者中的总体安全性与在多发性骨髓瘤患者中观察到的相似。在上述两类患者群中明显的区别为:虽然套细胞淋巴瘤患者出现外周神经病变、皮疹和瘙痒的报告率高于多发性骨髓瘤患者,但多发性骨髓瘤患者出现血小板减少、中性粒细胞减少、贫血、恶心、呕吐和发热报告率高于套细胞淋巴瘤患者。上市后经验依据全球上市后本品的用药经验,自发报告的不良反应列于表4中。不良反应根据发生频率分为:很常见(>1/10);常见(>1/100,且1/10);少见(>1/1000,且<1/100);罕见(>1/10000,且<1/1000);极罕见(<1/10000,包括个别病例)。如下自发报告的不良反应数据并不能精确评价在临床试验和流行病学研究中得出的发生率。并不代表临床试验或流行病学研究中所示的真实发生率。
药物相互作用[2]
体外和动物离体研究显示,硼替佐米是细胞色素P450(CYP)酶系1A2、2C9、2C19、2D6和3A4的弱抑制剂。由于CYP2D6对硼替佐米代谢的作用有限(7%),故可以预期慢代谢表型CYP2D6不会影响硼替佐米的整体分布。在一项药物相互作用的研究中,评价了酮康唑 (CYP3A4强效抑制剂) 对硼替佐米的作用,12例患者的数据结果显示硼替佐米AUC平均值增加了35%。因此,当硼替佐米与CYP3A4抑制剂 (如:酮康唑、利托那韦) 合用时应对患者进行密切的监测。
在一项药物相互作用的研究中,评价了奥美拉唑 (CYP2C19强效抑制剂) 对硼替佐米的作用,17例患者的数据结果显示其对硼替佐米的药代动力学无明显影响。在一项药物相互作用的研究中,评价了苯丙氨酸氮芥和强的松联合疗法对硼替佐米的作用,21例患者的数据结果显示硼替佐米AUC平均值增加了17%。此结果被认为无临床相关性。在临床试验中,有糖尿病患者口服降糖药后出现低血糖症和高血糖症的报道。在使用本品治疗时,应密切监测口服抗糖尿病药患者的血糖水平,并注意调节抗糖尿病药的剂量。告知患者应谨慎合用可能会引起周围神经病变的药物 (如胺碘酮、抗病毒药、异烟肼、呋喃妥因或他汀类) 及引起血压降低的药物。
主要参考资料
[1] CN201810857550.3 一种硼替佐米的纯化方法
[2] 注射用硼替佐米
