基本描述
N-叔丁基甘氨酸盐酸盐呈白色固体,CAS号是6939-23-7,分子式是C6H14ClNO2,分子量是167.63。熔点是223-224℃,一般在室温下储存。N-叔丁基甘氨酸盐酸盐分子中同时具有酸性和碱性官能团,在水中可电离,具有很强的亲水性,但属于非极性氨基酸,溶于极性溶剂,而难溶于非极性溶剂 ,而且具有较高的沸点和熔点,通过水溶液酸碱性的调节以使N-叔丁基甘氨酸盐酸盐呈现不同的分子形态[1]。
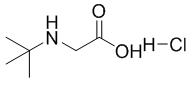
图1 N-叔丁基甘氨酸盐酸盐的结构式。
合成
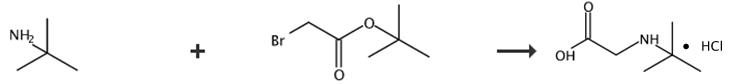
图2 N-叔丁基甘氨酸盐酸盐的合成路线[2]。
在45-50℃下,向叔丁胺(1.57升)和甲苯(1.35升)的混合物中加入溴乙酸叔丁酯(420毫升)。混合物在50-60°C下搅拌1小时,温度在1小时内升高至75°C。在75°C下2小时后,混合物冷却至-12+3°C并静置1小时。通过过滤收集固体,通过蒸馏(30-40°C,25-35 mm Hg)将滤液浓缩至825 mL的体积。将所得浓缩物冷却至20-25°C并添加6N HCl(1.45 kg)。3小时后,分离各相,通过蒸馏(30-40°C,25-35毫米汞柱)将水相浓缩至590毫升。加入异丙醇(2.4升),并通过蒸馏(15-20°C,10-20毫米汞柱),将混合物浓缩至990毫升。在30分钟内将所得浆料冷却至-12+3°C,静置1小时。过滤收集固体,用i-PrOH洗涤,并干燥(45+3°C,10毫米汞柱)24小时,得到(407.9克,86%)所需产物。N-叔丁基甘氨酸盐酸盐,收率407.9 g,86%。

图3 N-叔丁基甘氨酸盐酸盐的合成路线[3-4]。
方法一:将丙烯酸(2.75 mL,40.0 mmol)在四氢呋喃(220 mL)中的溶液冷却至-78℃,并在-78℃下缓慢添加至溴乙酸叔丁酯(420毫升)在四氢呋喃(60 mL)中溶液中。在-78℃下2小时后,将黄色混合物在室温下搅拌12小时。在0℃下加入水(300ml),并在减压下部分蒸发溶剂。残余物用TBME提取。通过缓慢加入浓盐酸在搅拌和冰冷却下酸化水层,并用乙酸乙酯(2 x 250ml)萃取,并干燥有机层。蒸发溶剂得到所需的N-叔丁基甘氨酸盐酸盐。
方法二:向3a-f(10 mmol)和2,6-二甲基苯胺(3.47 mL,20 mmol)在20 mL干燥CH2Cl2中的冷却(0°C)溶液中滴加Tf2O(3.36 mL,4 mmol)。搅拌10分钟后,移除冰浴,将反应混合物加热至25°C并搅拌过夜。向反应混合物中加入己烷(20ml)。滤出吡啶盐,用乙酸乙酯洗涤沉淀。滤液用饱和NH4Cl、饱和NaCl和H2O洗涤,用MgSO4干燥,真空浓缩至干。将残余物从己烷-乙酸乙酯中重结晶,以90-95%的产率提供4a-f的白色晶体N-叔丁基甘氨酸盐酸盐。
应用
N-叔丁基甘氨酸盐酸盐用作缓冲剂,用于组织培养基的制备,铜、金和银的检验,医药上用于治疗重症肌无力和进行性肌肉萎缩、胃酸过多、慢性肠炎、儿童高脯氨酸血症等疾病的药物的中间体[5-6]。N-叔丁基甘氨酸盐酸盐在化肥工业中用作脱除二氧化碳的溶剂。在医药工业中,可用作氨基酸制剂、金霉素的缓冲剂和作为抗巴金森氏病药物L-多巴的合成原料,又是咪唑酸乙酯的中间体,其本身也是一种辅助治疗药,可治疗神经性胃酸过多,对抑制胃溃疡的酸过多亦有效[7]。在食品工中业用作合成酒、酿造制品、肉食加工和清凉饮料的配方和糖精去基剂,作为食品添加剂,N-叔丁基甘氨酸盐酸盐可作为调味品单独使用,也可以与谷氨酸钠、DL-丙氨酸,枸橼酸等配合使用。在其他工业方面,可作为pH调节剂,添加于电镀液,或者用作其他氨基酸的原料。在有机合成和生物化学中用作生化试剂和溶剂[8-10]。
参考文献
[1] D. Enders, T. Hassel, R. Pieter, B. Renger, D. Seebach, Reductive denitrosation of nitrosamines to secondary amines with hydrogen/Raney nickel, Synthesis (8) (1976) 548-50.
[2] C.V. Greco, W.H. Nyberg, C.C. Cheng, Synthesis of sydnones and sydnone imines, J. Med. Pharm. Chem. 5 (1962) 861-5.
[3] M. Guo, New synthetic method of tigecycline, Xibei Yaoxue Zazhi 29(5) (2014) 516-518.
[4] J. Kihlberg, R. Bergman, B. Wickberg, Synthesis of strombine. A new method for monocarboxymethylation of primary amines, Acta Chem. Scand., Ser. B B37(10) (1983) 911-16.
[5] S. Liu, Y. Yao, Z. Li, H. Zhang, Synthesis of tigecycline, Zhongguo Yiyao Gongye Zazhi 42(4) (2011) 241-244.
[6] F. M'Henni, Z. Mighri, Synthesis of N-alkyl and N,N-dialkyl α-amino monoacids by monocondensation of sodium chloroacetate with primary and secondary amines, J. Soc. Chim. Tunis. 11 (1984) 3-12.
[7] F.M. Sabbatini, S. Melotto, G. Bernasconi, S.M. Bromidge, L. D'Adamo, M. Rinaldi, C. Savoia, C. Mundi, C. Di Francesco, L. Zonzini, V.J.A. Costantini, B. Perini, E. Valerio, A. Pozzan, E. Perdona, F. Visentini, M. Corsi, R. Di Fabio, Azabicyclo[3.1.0]hexane-1-carbohydrazides as Potent and Selective GHSR1a Ligands Presenting a Specific in vivo Behavior, ChemMedChem 6(11) (2011) 1981-1985.
[8] D. Seebach, D. Enders, Lithiated methylnitrosamines. Nucleophilic α-sec-aminomethylation, Chem. Ber. 108(4) (1975) 1293-320.
[9] A. Vanoost, L. Petit, A chromatography-free synthesis of racemic salbutamol hemisulfate, Tetrahedron Lett. 61(28) (2020) 152126.
[10] J.C. Wong, G. Tang, X. Wu, C. Liang, Z. Zhang, L. Guo, Z. Peng, W. Zhang, X. Lin, Z. Wang, J. Mei, J. Chen, S. Pan, N. Zhang, Y. Liu, M. Zhou, L. Feng, W. Zhao, S. Li, C. Zhang, M. Zhang, Y. Rong, T.-G. Jin, X. Zhang, S. Ren, Y. Ji, R. Zhao, J. She, Y. Ren, C. Xu, D. Chen, J. Cai, S. Shan, D. Pan, Z. Ning, X. Lu, T. Chen, Y. He, L. Chen, Pharmacokinetic Optimization of Class-Selective Histone Deacetylase Inhibitors and Identification of Associated Candidate Predictive Biomarkers of Hepatocellular Carcinoma Tumor Response, J. Med. Chem. 55(20) (2012) 8903-8925.
