抗原是能刺激机体产生抗体,并能与之特异性结合发生反应的物质。前者为免疫原性,后者为免疫反应性,统称为抗原性。同时具备二种属性的为完全抗原,只有免疫反应性,而不具备免疫原性者为不完全抗原,亦称半抗原。半抗原只有与蛋白质载体结合时,才具有免疫原性。抗原一般指完全抗原而言,主要为蛋白质及其复合物。
构成抗原的条件
异源性 抗原应为非自身物质,一般为异种物质,但同种而不同个体间的某些物质,如血型抗原、组织相容抗原等有时也有免疫原性。因此进行异体组织或器官移植时,可引起移植排斥反应。一般来说自身物质没有免疫原性,但某些隐蔽成分,如眼球晶体、精子蛋白等与免疫系统隔绝,一旦因外伤、感染等原因进入血流时,即可与免疫活性细胞接触而成为自身抗原。此外,自身物质由于烧伤、感染、药物及射线的影响,使其蛋白质结构发生改变,亦可成为自身抗原。
分子大小 具有免疫原性的物质分子量常大于10 000。分子量小于5 000者一般免疫原性很弱,在1 000以下的小分子为半抗原,本身没有免疫原性,需与蛋白质结合后才有免疫原性。
分子结构 分子结构和空间构象复杂者抗原性强。带苯环和杂环的芳香族氨基酸的蛋白质,较带直链氨基酸者抗原性强。某些天然蛋白,如胰岛素、鲱精蛋白等虽其分子量只有5 000左右,但其所含氨基酸复杂多样,因而具有良好的免疫原性。
物理状态 颗粒性抗原易被吞噬加工是良好的抗原。免疫原性弱的可溶性抗原,由于分子聚集而使质点增大或吸附于氢氧化铝等大分子颗粒上,可显著增加其免疫原性。
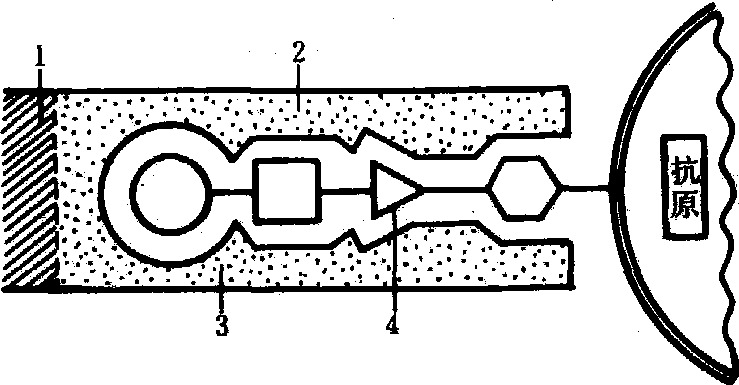
图 1 抗原决定簇与抗体的抗原结合点的互补关系抗体(CH-CL); 2. 抗体(VH-VL); 3. 抗体的抗原结合点; 4. 抗原决定簇
抗原决定簇 抗原的特异性决定于其分子表面具 有立体构型的化学基团,称为抗原决定簇,通常由5~7个氨基酸残基或单糖残基组成。一个蛋白质分子可具有多个不同的抗原决定簇,据估计每5 000分子量约有一个决定簇,其余部分则为载体,半抗原一般只有一个决定簇,完全抗原可以看作是半抗原和载体的复合物(图1)。
天然抗原
细菌抗原 细菌具有复杂的抗原组成,通常可以区分为菌体抗原(O抗原)、鞭毛抗原(H抗原)和荚膜抗原(K抗原)三类。某些细菌的菌毛也称为K抗原(图2)。每一种细菌都是一个由不同抗原成分组成的复合 体,各有特异性。因此,可用以区别不同的种,并可把同一种细菌区分为不同的血清型,细菌的外毒素也是一种很好的天然抗原。
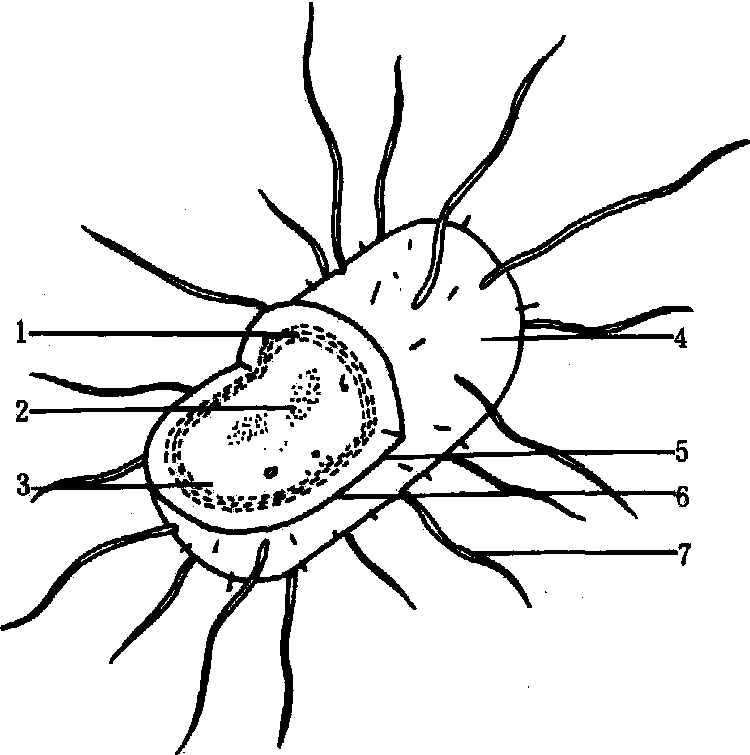
图 2 细菌的结构及其重要抗原的位置
1. 细胞膜; 2. 核糖核蛋白; 3. 细胞浆液酶等; 4. 菌毛(某些K抗原); 5. 荚膜(K抗原); 6. 细胞壁 (O抗原); 7. 鞭毛(H抗原)
病毒抗原 各种病毒都有自己的抗原结构,有囊膜病毒的抗原特异性主要由囊膜上的纤突决定,如流感病毒囊膜上的血凝素(H)和神经氨酸酶(N),是流感病毒亚型分类的基础。无囊膜病毒则主要由病毒的衣壳蛋白所组成,是病毒分类和鉴定的重要依据。
寄生虫抗原 原虫、蠕虫及其虫卵等均具有独特的抗原组成,但其免疫原性一般较弱,特异性不高,交叉反应较多,但不同的种常应用血清学试验进行鉴定。
动植物抗原 动植物体内的各种组分均具有良好的抗原性,某些动物性药物如虎骨、阿胶、熊胆等均具有特异的抗原性,很易用血清学方法加以鉴定。
植物蛋白质亦具有各自的抗原特征,亦可应用血清学方法进行物种鉴定。杂交、嫁接或用生物技术培育成的杂交后代,均可用血清学的方法加以鉴别。
酶 酶是蛋白质,具有良好的抗原性。在酶学研究中,可利用抗酶抗体来测定自然物中存在微量的酶,也可用免疫亲和层析来提纯酶制品。
激素 大分子多肽类激素是良好的天然抗原。分子量小于5 000的多肽激素和类固醇激素则需连接于蛋白质载体,做成人工复合抗原才能刺激动物产生抗体。自1959年伯森(Berson)和耶娄(Yallow)建立激素的放射免疫测定(RIA)技术以来,已有近60种激素建立了免疫测定技术,为生命科学进入分子水平提供了重要手段。
植物激素均为小分子半抗原,自韦勒(Weiler)和曾克(Zenk) 1983年将 (RIA)和酶免疫测定(EIA)技术引入植物学以来,植物激素的免疫测定技术也有了迅速发展。并已在植物生理生化、生态、遗传、育种和组织培养、快繁等方面广泛应用。
人工抗原
合成抗原 用化学方法将已知的氨基酸按一定的顺序聚合成大分子多肽,使之具有抗原性。这种抗原早期主要用于研究免疫原性的分子基础,如抗原决定簇的组成和结构,决定簇的大小,分子结构与免疫原性的关系等。现已有应用人工合成保护性肽段,并将其接于蛋白质载体上,制成合成肽疫苗,前景乐观。
结合抗原 将某种不具免疫原性的简单化合物(半抗原)连接于蛋白质载体上,使其成为具有良好免疫原性的半抗原载体复合物,可用以制备抗半抗原抗体。70年代后,由于连接技术的进展,几乎任何具有生物活性的小分子物质均可制成结合抗原,制备特异性抗体。并用以建立RIA或EIA技术。目前已有300多种此类物质建立了免疫测定技术。
【抗体】
抗体能与抗原特异性结合的免疫球蛋白(Ig)为抗体。抗体具有特殊的性质即特异性。抗体是由相应抗原刺激机体免疫系统所产生的免疫球蛋白,所以抗体具有高度的特异性,它仅能与相应的抗原发生反应。抗体的特异性是由于它在化学结构上具有与抗原决定簇相应的特异决定簇,二者可以相互识别而特异的结合。抗原与抗体反应的特异性具有重要的理论和实践意义。它可用于特异性蛋白质的鉴定、分离纯化和分析(如放射免疫分析、酶联免疫分析),以及肿瘤的早期诊断(α-甲胎蛋白诊断肝癌)、一些疾病的预防(卡介苗、牛痘苗、白喉类毒素)和治疗(破伤风抗毒素、狂犬病毒抗血清)等。但是,蛋白质的抗原性有时也可能带来严重的危害性,如异体蛋白进入体内可产生病理性的免疫反应,甚至危及生命。因此,对一些生产过程中可带入异体蛋白的药物,如注射用生化药品、中草药制剂和抗菌素等,其主要质量标准之一是过敏试验应符合规定,以保证药品的安全性。
抗体是与抗原进行特异性结合的Ig糖蛋白,电泳时,大多以γ球蛋白移动。所有免疫球蛋白的共同结构是:都由两条轻(L)多肽链和两条重(H)多肽链构成,排列如图所示。人类免疫球蛋白已鉴定出5种,它们是:IgG,IgA,IgM,IgD和IgE,差异发在H链上,分别由称为γ、α、μ、δ和ε的H链构成。L链只有κ和λ两型,皆以二硫链(S-S)与重链结合。H链也以二S-S键相互结合。
有关免疫球蛋白的结构和功能方面的认识,主要是通过对IgG的研究而取得的。木瓜蛋白酶(Papain)(蛋白水解酶)使IgG分子在铰链区(hinge region)分解为3个分段,其中两个分段是相似的,皆与抗原结合(抗原结合分段[ fragment antigen binding,Fab]),含两条轻链和以S-S桥相连的附近H链。第3分段不与抗原结合,而能迅速晶化(crystallized),故为Fc分段。与细胞结合、补体结合和通过胎盘的部位,皆在此分段。IgG分子中约1/3是Fc分段,另约2/3是Fab分段。
L链和H链的羧基末端处都有 一个氨酸顺序相同的区域,即恒定区(constant region)或C区(CL或CH),氨基末端则有一氨酸顺序不 一的区域,称为可变区(variable region)或V区(分别为VL或VH)。CH段由3个大致相等的小区构成,即CH1、CH2、CH3。CH1以铰链区与其他CH区分开。IgG分子的V区和C区都有链内二硫键存在。糖类与CH2区结合,补体亦结合于此。
V区有些部位的氨酸顺序变异极大,称为超变区(hypervariable regions)。VL段有3个超变区,VH段有4个超变区。相邻二超变区之间的残基,即“支架”残基。VH和VL区含有抗原结合沟,位于抗体分子的Fab部分内。VH和VL区的折叠,还使超变区极为接近,形成与表位相补的结构。支架残基的作用是使超变区的抗原结合部位保持适当的排列。正是由于超变区的改变,形成无数特异性抗原结合部位,才能适应千差万别的抗原决定簇的需要。
IgG是人类血清中的主要免疫球蛋白。抗原激发后产生的主要抗体类型,就是这种单体。胎儿虽不产生IgG,但它能迅速通过胎盘,故胎儿和新生儿血清中皆能检出母体的IgG。根据重链的不同,IgG可分为4个亚类:γ1,γ2,γ3,γ4。有些抗原激起的抗体反应,4亚类可说旗鼓相当,但有些抗原则是以其中某一亚类为主。作用于糖类的抗体常为IgG2;抗DNA抗体主要是IgG1和IgG3。在各种亚类中,IgG3的合成速率最低,而分解速率最高,血清半衰期最短。有关IgG的各种生物学和物理特性,均见表1及表2。
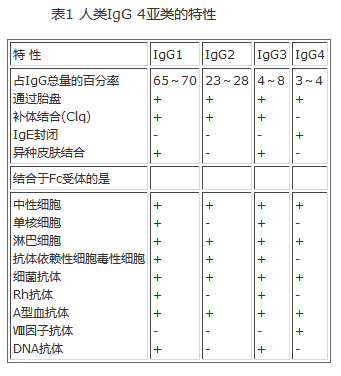
表1 人类IgG 4亚类的特性
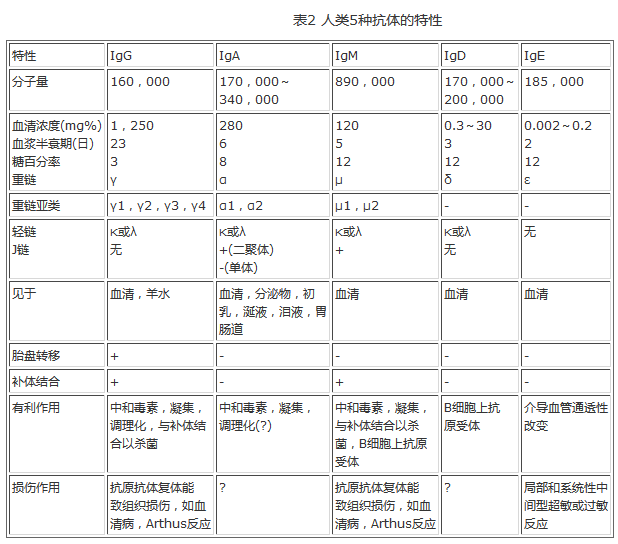
表2 人类5种抗体的特性
IgA有单体也有二聚体。它是分泌物中的主要免疫球蛋白,并以二聚体存在,后者是以多肽连接链(J链)和二硫桥互连的。此外,分泌物(涎液、泪液、肠液中的二聚体,还含有1条称为分泌成分(SC)或分泌片(secretary piece)的多肽链。SC似能保护二聚体IgA,免于胃肠道蛋白水解酶的消化作用。它是由局部浆液型分泌性上皮细胞产生的,位于这些细胞的表膜,这使人想到:SC可能是二聚体IgA的受体。SC片越过或由这些细胞间通过时,不断增加,据认为,分子之能藉胞泌作用(与胞饮作用相对)通过粘膜上皮,即缘于此。因此,分泌性IgA的生成,就可认为是不寻常的,因为它是两种不同类型细胞(即抗体分泌性浆细胞和浆膜上皮细胞)的协作产物。按其α重链的不同,IgA可分为IgA1和IgA2两亚类。后者又可按其遗传标记(genetic markers)的不同,分为A2m(1)和A2m(2)两亚种。
IgM是的免疫球蛋白(分子量890,000),为5个相同亚单位组成的五聚体,各有两条K或λ轻链和两条μ重链。此外,IgM还有1个与二聚体IgA相似的J链,使分子结合更为牢靠。IgM对补体结合至为有效,对红细胞和细菌的凝集作用以及杀菌反应,也比IgG有效得多。单体IgM见于B细胞表面,据信是起抗原受体的作用。初次给予1剂抗原后,经过一段起始延搁,首先出现的抗体就是IgM,一般于7日到达顶峰。但此时IgG抗体亦可检出,一般于10~14日到达最高效价。在IgG效价增长期间,IgM效价开始下降,迨至初次抗原剂量4~5周后,已难以检出。2次反应(回忆反应或增强反应)时,IgM和IgG效价皆呈指数性增长,但IgG反应显然更强,持续也更久;IgM效价则与1次反应时相同,或略有增高。产IgM细胞记忆功能不佳,虽经2次抗原激发,亦无典型回忆反应。故IgM的存在有助于确定是否为新发感染。有证据提示带IgG或IgA淋巴细胞是由带IgM或IgM/IgD淋巴细胞前体发育来的。
IgD是由两条δ重链和两条κ或λ轻链构成的单体。在血清免疫球蛋白中,含量甚微,合成速率大约不到IgD的1/100。IgD的分解速率亦高,血浆半衰期只有3日。IgD不与补体结合,也不对皮肤致敏。大多数脐带和成人的B细胞表面,都有IgD,有人认为IgD可能是一种早期抗原细胞受体。
IgE是由两条ε重链和两条κ或λ轻链构成的大单体。血清含量至微,血浆半衰期最短,合成速率最低,分解速率在各种免疫球蛋白中也是最快的。IgE在即发型超敏反应中起主要作用。它以Fc部分紧密地结合在肥大细胞和碱性细胞的受体上。继而抗原(变应原)与临近二IgE分子相互作用,形成抗原桥。由此引起的局部膜改变,促使介质释出(组胺、慢反应物质、酸性细胞趋化因子),从而触发即发型超敏反应。特应性(atopic)者的变应原特异性IgE水平增高。据认为IgE对寄生虫有保护作用,但尚无确切资料得以证实。
免疫球蛋白本身也有抗原性,这可由将它们注入不同种属的动物或种属相同而遗传背景有别的动物得到证明。除异型(种特异性)决定簇外,还从免疫球蛋白上发现3种不同类型的抗原决定簇,它们是:同型(isotypic)、同种异型(allotypic)和个体基因型(idio-typic)抗原决定簇。
