介绍
2,3-二甲氧基-5-甲基-1,4-苯醌的分子骨架以对苯醌为母体,分子式为 C₉H₁₀O₄,分子量 182.17,其结构特殊性在于苯环的 2、3 位连有二甲氧基,5 位取代甲基,外观呈现为红色结晶性粉末,无臭无味。易溶于甲醇、乙醚、二氯甲烷等有机溶剂,几乎不溶于水。化学稳定性较好,但作为醌类化合物,具有氧化还原活性。

图一 2,3-二甲氧基-5-甲基-1,4-苯醌
合成及应用
以 3,4,5 - 三甲氧基甲苯为原料,经 Vilsmeier-Haack 反应、Dakin 反应及氧化三步法,总收率可达 72.3%;或以对甲酚为起始物,通过溴化、甲氧基化等四步反应,实现纯度 99% 的2,3-二甲氧基-5-甲基-1,4-苯醌制备。
2,3-二甲氧基-5-甲基-1,4-苯醌是化学合成辅酶 Q₁₀的关键母体,自身还具有显著生理活性,可以作为细胞代谢激活剂,能促进氧化磷酸化反应,可用于改善心肌能量代谢、治疗病毒性肝炎等疾病。后续研究进一步发现,其衍生物如双辅酶 Q₀具有独特的分子内电子传递特性,在抗氧化与细胞保护中展现潜力。
来源
2,3-二甲氧基-5-甲基-1,4-苯醌可以从台湾特有真菌 Antrodia salmonea 的菌丝体中分离得到。Antrodia salmonea(多孔菌科 Antrodia 属)是 2004 年首次鉴定的新物种,生长于台湾特有树种峦大杉的腐朽树干中,在台湾民间医学中被用于治疗腹泻、腹痛、高血压及肝癌等疾病,同时兼具解毒功效。该真菌的子实体与菌丝体均富含活性成分,此前研究已从中分离出抗氧化性三萜类、萘醌类化合物,而聚焦于其菌丝体的氯仿提取物,发现其对 KB(表皮样癌)、HepG2(肝癌)等肿瘤细胞株具有细胞毒性,进而追踪分离得到2,3-二甲氧基-5-甲基-1,4-苯醌。
分离纯化流程
通过规模化发酵获得 A. salmonea 菌丝体,经真空浓缩后得到残留物,采用溶剂分步萃取法,以氯仿(CHCl₃)为萃取溶剂(4L×3 次),获得氯仿提取物。后续通过多级色谱分离技术纯化得到:亚组分 F4-3 经硅胶柱层析(正己烷 / 乙酸乙酯 = 4:1 洗脱)初步纯化后,通过制备薄层色谱(展开剂:正己烷 / 乙酸乙酯 = 3:1)精制,最终获得2,3-二甲氧基-5-甲基-1,4-苯醌,分离得率为 30mg。
光谱特征:IR 光谱中应呈现醌羰基(C=O)的特征吸收峰(约 1660~1640 cm⁻¹),¹H NMR 光谱可检测到甲基(-CH₃)及二甲氧基(-OCH₃)的特征质子信号,与同类苯醌化合物光谱规律一致[1]。
肿瘤细胞毒性
对2,3-二甲氧基-5-甲基-1,4-苯醌进行了 4 种人肿瘤细胞株(KB、HepG2、H2058、HA22T)的细胞毒性筛选,结果显示化合物 5 具有显著的靶向细胞毒性:对 H2058(恶性黑色素瘤细胞株)的 IC₅₀值为 30μM;对 HepG2(肝癌细胞株)的 IC₅₀值为 37μM;对 KB 细胞株活性较弱,对 HA22T 细胞株无明显抑制作用(IC₅₀>40μM)。
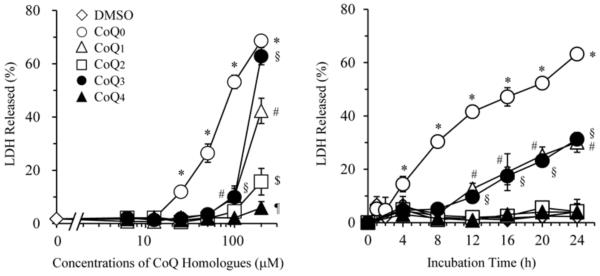
图二 2,3-二甲氧基-5-甲基-1,4-苯醌的细胞毒性及同源物
对比同批分离的其他化合物,2,3-二甲氧基-5-甲基-1,4-苯醌的细胞毒性虽弱于 2 - 甲氧基 - 6 - 甲基对苯醌,但仍是该提取物中活性较强的成分之一。其细胞毒性机制推测与苯醌类化合物的共性作用相关:通过参与细胞内氧化还原反应产生活性氧,或与生物大分子(如 DNA、酶)结合,干扰肿瘤细胞代谢与增殖过程[2]。
参考文献
[1]Takahashi T ,Mine Y ,Okamoto T .2,3-Dimethoxy-5-methyl-p-benzoquinone (Coenzyme Q0) Disrupts Carbohydrate Metabolism of HeLa Cells by Adduct Formation with Intracellular Free Sulfhydryl-Groups, and Induces ATP Depletion and Necrosis[J].Biological and Pharmaceutical Bulletin,2018,41(12):1809-1817.DOI:10.1248/bpb.b18-00497.
[2]Ximena S ,Ronald F ,Sheyla Z , et al.Bioactive components of marine brown macroalgae from the south coast of Peru[J].ABSTRACTS OF PAPERS OF THE AMERICAN CHEMICAL SOCIETY,2019,257
