简述
扁桃酸(α-羟基苯乙酸)是一种分子式为C8H8O3,分子量为152.14的化合物,英文名为DL-Mandelic acid,有左旋和右旋的光学异构体,性状一般为白色斜方片状晶体或结晶状粉末,易溶于乙醇、乙醚,见光分解变色。关于该物质的理化性质,其熔点为120~122 ℃,水溶解度约为1g/6.3 mL[1-2]。

制备方法
方法一
将苯甲醛和酸性或碱性催化剂混合,补充水,加入氧化氢气体或氢氰酸水溶液,反应合成扁桃腈;加入无机酸水解,水解完全后形成含有扁桃酸和无机酸铵盐的水解液;在水解液中补充循环母液和/或水,冷却结晶,离心分离得到扁桃酸粗品及含有扁桃酸和无机酸铵盐的母液;在母液中,加入无机碱性物质,常压或减压浓缩后冷却结晶,离心除去无机酸铵盐,剩余母液循环至水解工序使用;扁桃酸粗品加水溶解,加活性炭脱色,滤液结晶,离心,干燥得扁桃酸成品。该制备方法重结晶母液可以循环使用,扁桃酸收率高,成本低[3]。
方法二
除上述制备方法,还可通过超声波相转移催化技术合成扁桃酸。实验探讨了反应温度,反应时间,催化剂用量,相转移催化剂种类,超声功率和加碱时间对产品收率的影响。确定最佳工艺条件为:苯甲醛与氯仿摩尔比为1:2.5,反应温度为60℃,反应时间为2 h,超声功率为120 W,PTC用量为苯甲醛用量的3%(摩尔分数)。最佳反应条件下产品收率可达86.1%,比传统的苯甲醛法(50%~52%)和常规的相转移催化法(78%)都高。滴加碱时间由常规转移催化法的4~5 h缩短到1 h,加碱速度易于控制[4]。
拆分方法
用D-(-)-苯甘氨酸丁酯及其盐酸盐作为拆分剂,在水或醇的反应体系中,与扁桃酸反应可以制备R-(-)-扁桃酸和S-(+)-扁桃酸。其中R-(-)-扁桃酸有98.9%的收率和32%的光学纯度,而S-(+)-扁桃酸有90.1%的收率和66.73%的光学纯度[5]。
测定方法
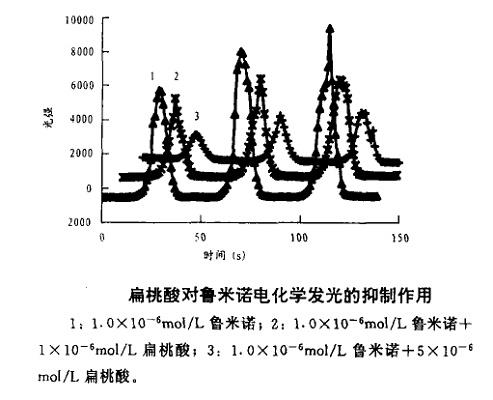
基于发现的扁桃酸对鲁米诺(Luminol)电化学发光强烈的抑制作用,建立了电化学发光法测定扁桃酸含量的新方法。扁桃酸浓度在8.2×10-8~1.5×10-5mol/L范围内与发光减少值分段呈良好的线性关系,检出限为1.5×10-8mol/L,对2.0×10-6mol/L扁桃酸平行测定10次,其相对标准偏差为3.18%。该法具有简便,快速,灵敏的特点,应用于扁桃酸测定,结果满意[6]。
应用
扁桃酸是一类重要的药物中间体,可用于合成血管扩张药环扁桃酯、眼科药物羟苄唑、中枢神经兴奋药匹莫林及苯并二呋喃酮染料[7]。此外。基于其优异的杀菌活性,扁桃酸类化合物还可用于防治番茄晚疫病,马铃薯晚疫病和葡萄霜霉病等[8]。
毒性研究
为了探讨扁桃酸对人阴道黏膜上皮细胞(VK2/E6E7)与精子的细胞毒性损伤,研究人员以不同浓度的扁桃酸处理高活力精子20 s,计算机辅助精子分析仪测定精子活率,扫描电子显微镜检测精子受损情况。1.25,2.5 g·L-1 扁桃酸和4.0 g·L-1壬苯醇醚(nonoxyno1-9,N-9)处理VK2/E6E7细胞,MTT法检测细胞活性,ELISA试剂盒检测乳酸脱氢酶(LDH)释放率,并用流式细胞法检测细胞凋亡率。
结果,扁桃酸抑制精子活率的半数有效浓度约为1.25 g·L-1,最低有效浓度约为2.5 g·L-1。扫描电镜结果显示,扁桃酸处理组精子表面结构与对照组形态相似,无明显受损特征,N-9组精子严重受损。MTT实验结果表明,1.25 g·L-1扁桃酸组细胞存活率>95%,2.5 g·L-1 扁桃酸组细胞存活率约为50%。1.25,2.5 g·L-1 扁桃酸处理组LDH释放量只有微量检出,远低于N-9组。流式细胞检测表明,1.25,2.5 g·L 扁桃酸处理组中活细胞和晚期凋亡比例与对照组相近,早期凋亡细胞略少于对照组,死亡细胞稍多于对照组,N-9组大量细胞死亡。也就是说,扁桃酸对VK2/E6E7细胞毒性远低于N-9,其对精子的抑制作用不是通过破坏精子质膜与鞭毛来实现[9]。
参考文献
[1]刘良.扁桃腈和扁桃酸的技术进展[J].精细化工化纤信息通讯, 2002(1):6-6.
[2]彭彩云,李云耀.扁桃酸合成中的相转移催化剂[J].中南药学, 2005, 3(003):168-170.DOI:10.3969/j.issn.1672-2981.2005.03.014.
[3]王锋,罗克俊,朱庆川,等.DL-扁桃酸的制备方法:CN200510021135.7[P].
[4]凌绍明,隆金桥.超声波相转移催化合成扁桃酸[J].化学世界, 2005, 46(9):4.DOI:10.3969/j.issn.0367-6358.2005.09.012.
[5]臧健,王志军,吴怡祖.扁桃酸的光学拆分[J].精细化工中间体, 2005, 35(1):3.DOI:10.3969/j.issn.1009-9212.2005.01.015.
[6]吴翠敏,孔德贤,邱彬.电化学发光法测定扁桃酸含量的研究[J].福建分析测试, 2004, 13(2):3.DOI:10.3969/j.issn.1009-8143.2004.02.001.
[7]邱彬,吴翠敏,叶榕,等.毛细管胶束电动色谱分离测定扁桃酸和苯乙酮酸[J].福建医科大学学报, 2006, 40(1):2.DOI:10.3969/j.issn.1672-4194.2006.01.028.
[8]张金波,杨吉春,刘若霖,等.扁桃酸类杀菌剂的创制及其研究进展[J].农药, 2009, 48(2):6.DOI:10.3969/j.issn.1006-0413.2009.02.002.
[9]夏敏杰,王玉柱,黄超,等.dl-扁桃酸对人精子与阴道黏膜上皮VK2/E6E7细胞的毒性研究[J].中国现代应用药学, 2015, 032(004):391-395.

