在生命科学研究的微观世界中,细胞分化是一个动态、连续且复杂的过程,涉及大量基因的精密调控和细胞状态的逐步转变。传统 bulk 测序技术因掩盖了单细胞层面的异质性,无法捕捉细胞分化过程中的中间过渡状态,难以完整还原细胞从起始到终末的发育路径。而单细胞拟时序分析(Pseudotime Analysis)技术的问世,打破了这一局限。它以单细胞转录组数据为基础,通过挖掘基因表达的动态变化规律,构建细胞分化的虚拟时间轴,精准模拟细胞分化轨迹,成为解码细胞命运决定机制的核心工具,为发育生物学、肿瘤学、免疫学等领域的研究带来了突破性进展。
一、技术核心:理论基础与核心特征
(一)核心理论支撑
单细胞拟时序分析的核心理论源于对细胞群体异质性的深刻认知:细胞发育并非简单地划分为少数几个离散阶段,而是存在大量连续且渐进的中间过渡状态。这些过渡状态是细胞分化过程中基因表达逐步重构的关键阶段,承载着细胞命运转变的核心信息。通过单细胞测序技术获得的单细胞表达谱,能够真实反映每个细胞的基因表达特征,进而为评估细胞间的亲缘关系、推断细胞分化顺序提供了数据基础。

与传统的时间序列实验不同,拟时序分析无需对细胞进行连续的时间点采样,而是通过 “横断面” 式的单次样本检测,利用单细胞表达谱的差异信息,反向推测细胞群体的完整发育进程,因此被称为 “拟时序”—— 即通过计算模拟出的细胞发育时间,而非真实的物理时间。
(二)基因表达的核心规律
细胞分化过程中,基因表达的动态变化是拟时序分析的关键依据,其核心规律主要体现在两方面:
特征基因的时相特异性:不同发育时相的细胞会表达一套特定的特征基因,这些基因通常以转录因子(TF)为核心,构成调控细胞分化的分子网络。例如,在胚胎干细胞向神经元分化的过程中,Oct4、Sox2 等多能性转录因子的表达逐渐下调,而 NeuroD1、Map2 等神经元特异性基因的表达逐步上调。
表达变化的平稳性:在细胞分化的连续过程中,特征基因的表达并非剧烈波动,而是呈现出平稳上升或平稳下降的趋势。拟时序分析的核心目标就是捕捉这种平稳变化的基因表达模式,通过对细胞进行合理排序,让大部分基因的表达在虚拟时间轴上实现平滑过渡,从而真实还原细胞分化的分子动态过程。
二、关键原理:算法逻辑与轨迹构建
单细胞拟时序分析的核心是通过算法构建能够反映细胞分化关系的轨迹图,其底层逻辑与关键步骤如下:
(一)核心算法:最小生成树(Minimum Spanning Tree, MST)
拟时序分析中最常用的轨迹构建算法基于最小生成树原理。最小生成树是指在一个包含多个节点的无向图中,找到一棵连接所有节点且边的权重之和最小的树。在单细胞数据中,每个细胞被视为一个节点,节点间的权重由细胞表达谱的相似性(如欧氏距离、皮尔逊相关系数等)决定 —— 表达谱越相似的细胞,节点间的权重越小。通过构建最小生成树,能够找到连接所有细胞的最短路径之和,从而建立起细胞之间的 “亲缘关系” 网络,为后续的细胞排序提供基础。
(二)细胞排序与轨迹优化
在最小生成树的基础上,结合基因表达的平稳性规律,对所有细胞进行时间排序:
首先识别出具有显著时相特异性的特征基因(即表达随分化过程平稳变化的基因);
以这些特征基因为依据,对最小生成树中的细胞节点进行顺序调整,使特征基因的表达在节点序列上呈现连续的上升或下降趋势;
最终形成的细胞序列即为拟时序轴,轴上的每个位置代表细胞在分化过程中的一个特定状态,而整个序列构成的分支结构则对应细胞分化的不同路径(如单向分化、分支分化等)。
此外,轨迹构建后还可根据研究需求进行优化,例如重新选择时序方向(reverse)—— 当初始排序的分化方向与已知生物学事实不符时,可反转拟时序轴;或指定起始状态(root_state)—— 通过已知的干细胞或前体细胞标记基因,确定拟时序轴的起点,提升轨迹的生物学合理性。
(三)不同轨迹类型的适配
根据细胞分化的实际情况,拟时序分析可构建多种类型的轨迹,以适配不同的生物学场景:
线性轨迹:适用于细胞向单一方向分化的场景(如造血干细胞向红细胞分化);
分支轨迹:适用于细胞分化过程中出现命运分支的场景(如神经嵴细胞分化为神经元、胶质细胞或平滑肌细胞);
循环轨迹:适用于细胞存在周期性状态变化的场景(如细胞周期、干细胞自我更新与分化的循环)。
三、标准化分析步骤
(一)特征选择
特征基因的筛选是拟时序分析的基础,直接影响后续轨迹构建的准确性,主要通过三种方式实现:
高表达基因筛选:选取所有平均表达量(mean_expr)>0.1 的高表达基因,这类基因能够为细胞状态区分提供稳定的表达信号;
亚群特异基因筛选:可导入 Seurat 软件计算得到的特征基因,或利用 Monocle 软件分析获得的差异表达基因(DEG),这类基因具有细胞亚群特异性,能精准反映不同细胞群体的分化特征;
手动输入基因:基于已有的先验知识,手动输入与目标发育过程相关的已知基因集,进一步提升分析的针对性与有效性。
(二)数据降维与批次效应去除
在特征选择之后,需要进行数据降维处理。数据降维能够剔除冗余信息,让细胞轨迹更加简洁清晰,同时减少后续计算的复杂度。此外,若数据存在批次效应,需通过相应的技术手段去除,以避免批次差异对轨迹构建的干扰,确保分析结果的可靠性。
(三)细胞时间排序
这是拟时序分析的核心环节,需要对所有细胞进行顺序调换,以匹配模拟的分化轨迹。该过程往往需要消耗大量的计算资源和时间,且在分析过程中可根据实际研究需求,重新选择时序方向(reverse)和起始状态(root_state),从而更灵活地探索细胞分化的潜在路径。
四、技术应用核心场景
单细胞拟时序分析凭借其强大的轨迹构建与动态解析能力,已广泛应用于多个生命科学研究领域:
发育生物学:解析胚胎与器官发育中细胞分化路径及调控机制,如还原小鼠胚胎干细胞向三胚层分化轨迹,识别关键调控因子;
肿瘤学:揭示肿瘤细胞异质性与分化层级,探索肿瘤干细胞起源扩散,如发现肺癌细胞多表型分化分支,为靶向治疗提供依据;
免疫学:追踪免疫细胞发育成熟与活化轨迹,如T细胞胸腺到外周的分化、B细胞免疫应答中的增殖分化路径;
再生医学:评估干细胞移植后分化命运,优化治疗方案,如分析间充质干细胞向功能细胞分化轨迹,验证移植效果。
五、LabEx单细胞测序服务
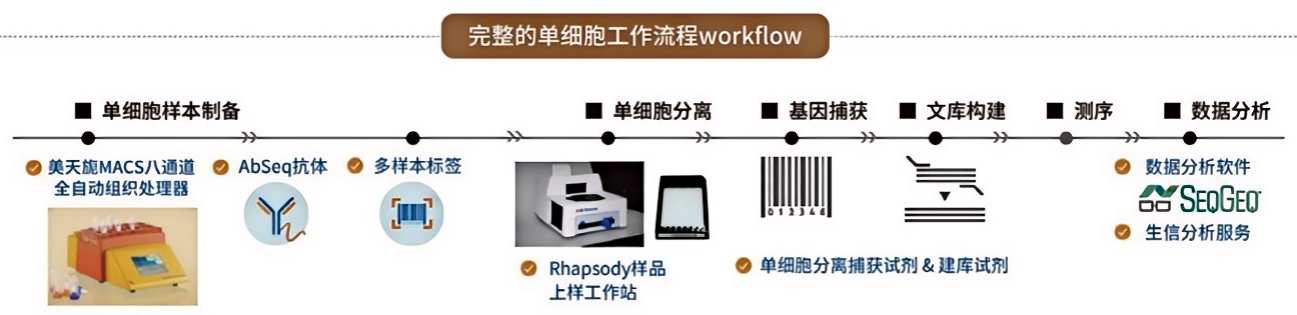
单细胞拟时序分析作为单细胞测序技术体系中的核心分析模块,广泛应用于发育生物学、肿瘤学、免疫学等多个研究领域,为解析细胞分化机制、肿瘤异质性、免疫细胞发育成熟等关键科学问题提供了重要的技术支撑。 为助力相关研究的开展,LabEx提供全面的单细胞测序配套服务,涵盖三大核心服务类型:
1. 单细胞转录组测序(ScRNA-seq):在单细胞水平对全mRNA表达谱进行精准检测,为拟时序分析提供核心数据基础;
2. 单细胞蛋白检测(Ab-seq):实现单细胞水平蛋白与基因表达的联合检测,属于多组学研究范畴,可提供人蛋白249个+小鼠蛋白219个的抗体组合,更大panel支持定制化服务;
3. 单细胞免疫组库测序:通过富集TCR/BCR基因并测序,全面解析免疫组库多样性,支持多种属检测,为免疫细胞相关的拟时序分析提供专属解决方案。
同时,LabEx搭建了完整的单细胞研究工作流程,从样本制备、单细胞分离、基因捕获、文库构建、测序到数据分析,配备专业的实验设备(如美天旎MACS八通道全自动组织处理器、SEOGEO上样工作站等)和数据分析软件,提供一站式的技术支持,确保从实验数据到拟时序分析结果的高效转化,为科研工作者提供可靠的技术保障。
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、PLA蛋白互作、多色免疫组化、DSP空间多组学等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。
