盐酸表柔比星(epirubicin hydrochloride,1),化学名(8S,10S)-10-[(3'- 氨基-2',3',6'- 三脱氧-α-L-阿拉伯吡喃糖基) 氧] -6,8,11- 三羟基-8- 羟乙酰基-1- 甲氧基-7,8,9,10- 四氢并四苯-5,12- 二酮盐酸盐,是法玛西亚普强( 现并入辉瑞) 开发的用于治疗乳腺癌、肺癌、肝癌的蒽环类抗肿瘤抗生素,1984 年在欧洲上市,1999 年在美国上市。
1可经发酵或半合成制得。发酵单位较低,目前还不具有工业化意义。半合成是以发酵得到的盐酸柔红霉素(21) 或盐酸多柔比星(2) 为原料,化学合成得到,1、2 和21 的结构式见图1。
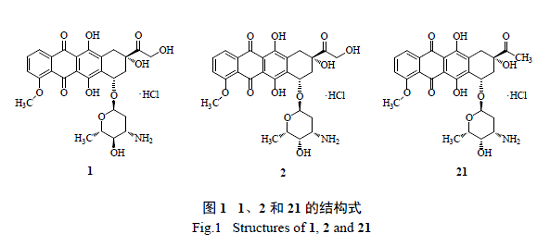
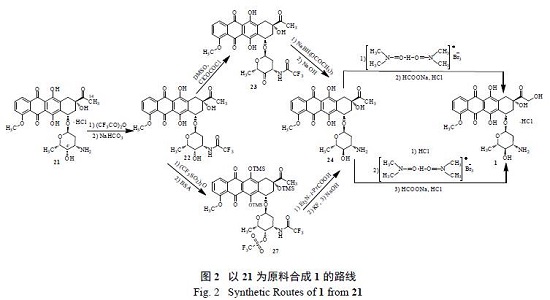
以21 为原料合成1 需翻转糖上4′- 位的羟基和在14- 位引入羟基,文献报道的合成路线有两条( 图2)。
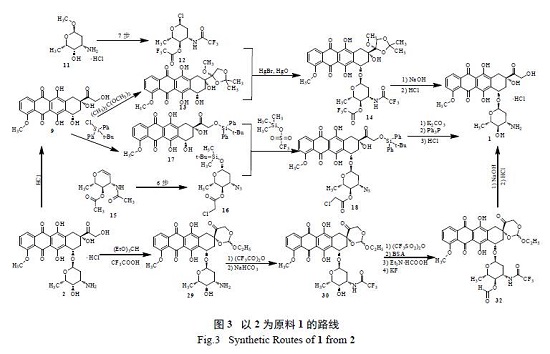
以2 为原料合成1 仅需翻转糖上4′- 位的羟基,文献报道的合成路线有3 条( 图3)。
以2 为原料合成1 仅需翻转糖上4'- 位的羟基,不需要在侧链引入羟基,因此本试验以2 为原料,设计了如图4 的新合成路线。
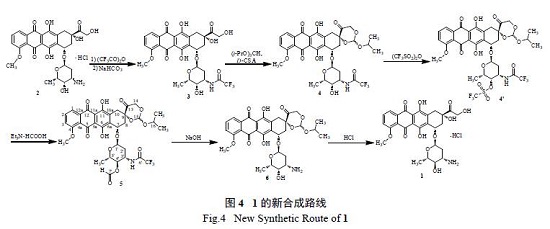
3 的合成:将溶剂由恶臭和毒性较大的吡啶改为环境友好、适合工业化生产的四氢呋喃;三氟乙酐的滴加温度由-20 ~ -15 ℃改为10 ~ 15 ℃;用碳酸氢钠使羟基酯转化为3,收率98%,可直接用于下步反应。
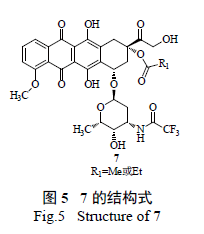
4 的合成:3 在D-(+) - 樟脑磺酸(D-CSA) 催化下与原酸酯反应得双羟基保护产物,考察了常见原酸酯的保护反应和产物的脱保护反应,原甲酸三甲酯、原甲酸三乙酯和原甲酸三丙酯活性较低,保护双羟基时,3 反应不完全;原甲酸三异丙酯、原乙酸三甲酯、原乙酸三乙酯、原丙酸三甲酯和原丙酸三乙酯保护时,3 反应完全,但后4 个原酸酯的保护产物在脱保护时除得到3,还得到大于80%难以继续水解的7( 图5),因此优选原甲酸三异丙酯进行双羟基保护,由3 合成4 收率98%,4 可直接用于下步反应。
4 理论上是一对差向异构体,HPLC 谱图也显示有两个位置很接近的峰,用硅胶柱色谱把两者分开,得4-1 和4-2,经质谱和核磁氢谱鉴定,两者为差向异构体。
5 的合成:4 溶于无水二氯甲烷,以吡啶为缚酸剂与三氟甲磺酸酐反应得4′,4′ 不经硅保护直接加入三乙胺甲酸盐得5,糖上羟基翻转,与专利相比革除了硅保护与耗时的脱硅保护,反应液不经后处理可直接用于下步反应。
1 的合成:上步反应液中加入甲醇和氢氧化钠溶液,-10 ~ -5 ℃碱水解糖上酯和酰胺得6,反应液不经后处理直接加入盐酸脱双羟基保护得1 粗品,后4 步反应收率58%,1 粗品纯度97%。粗品经NM100 大孔吸附树脂柱色谱纯化得1,纯度99.3%,纯化收率90%。
本研究以2 为原料,保护氨基得3,3 保护双羟基得4,与先保护双羟基再保护氨基相比,避免了三氟乙酸对双羟基保护基的破坏。4 和三氟甲磺酸酐反应使糖上羟基成酯活化得4′ 后直接与三乙胺甲酸盐反应得5,革除了硅保护和耗时的脱硅保护,5 脱糖上保护得6 后再脱双羟基保护得1。整条路线中化合物4、4′、5 和6 未见文献报道。1 粗品收率56%,高于文献路线[2,3,5—7],纯品收率50%,各步反应操作简单,反应条件温和,适合工业化。
