Ridgeback公司宣布,美国食品药品监督管理局(FDA)批准了口服抗病毒化合物EIDD-2801的IND申请。FDA的这一行动使Ridgeback可以在美国启动EIDD-2801的人体临床测试。
“我们感谢FDA专员史蒂文·哈恩(Steven Hahn)博士及其抗病毒部门的团队以前所未有的速度审查了我们的申请,以确保这种有前途的药物能够尽快进入临床开发”,Ridgeback首席执行官Wendy Holman说。“我们也非常感谢我们从备灾和响应助理部长(ASPR)那里获得的指导,包括在COVID-19首次出现前几个月进行的讨论,以帮助Emory / DRIVE尽快推动EIDD-2801的开发,解决全球新冠大流行问题。”
埃默里药物研究所(EIDD)所长兼DRIVE首席执行官George Painter博士说:“ FDA对我们IND的迅速批准使我们能够尽快启动EIDD-2801的人体测试。”“我们感谢合作者帮助我们快速组装此应用程序,并感谢FDA加快了这一过程。口服抗病毒药物将是对抗COVID-19的关键武器。”
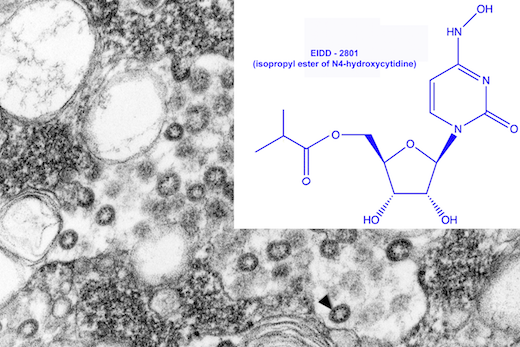
关于EIDD-2801
EIDD-2801是高效核糖核苷类似物的口服生物利用形式,可抑制多种RNA病毒的复制,包括SARS-CoV-2(COVID-19的致病因子)。通过两种不同冠状病毒(SARS-CoV1和MERS)的动物研究,证明EIDD-2801可以改善肺功能、减少体重减轻并减少肺中的病毒量。除了针对冠状病毒的活性外,在实验室研究中,EIDD-2801还显示出针对季节性流感、呼吸道合胞病毒、基孔肯雅病毒、埃博拉病毒、委内瑞拉马脑炎病毒和东部马脑炎病毒的活性。EIDD-2801的开发已经获得了美国国家过敏和传染病研究所(NIAID)联邦资金的部分资助。
