2020年10月8日,礼来制药与因赛特医疗共同宣布,最新数据显示巴瑞替尼联合瑞德西韦对比瑞德西韦单药,缩短了2019新型冠状病毒肺炎(COVID-19)患者的恢复时间、提高了临床获益。
这些数据来自ACTT-2试验的额外有效性与安全性数据,ACTT-2试验是由美国国立卫生研究院(NIH)下属国家过敏和传染病研究所(NIAID)发起的适应性COVID-19治疗试验。
这些数据在国际流感及其他呼吸道病毒疾病学会病毒组的“COVID-19治疗方法“特别线上会议发布。试验中取得获益的患者来自于需要辅助供氧的患者(基线水平有序8分量表的第五级)以及需要高流量吸氧、无创通气(基线水平有序8分量表的第六级)。
最新试验数据进一步显示,在接受巴瑞替尼用药的COVID-19住院患者中取得临床结局的改善(包括死亡率数据)。根据此前公布的信息,ACTT-2试验达到主要终点,巴瑞替尼联合瑞德西韦治疗的患者中位恢复时间由8天缩短至7天,以及12.5%的病情改善(IR:1.16; 95% CI:1.01,1.32; p=0.04)。该研究恢复的定义为受试者健康状况能够达到出院标准,即受试者不再需要辅助供氧或在医院接受持续医疗护理,或在第29天不再住院。该研究还达到了预设的次要终点。使用从完全恢复至死亡的有序8分量表,比较第15天的患者结局,巴瑞替尼联合瑞德西韦的临床改善比值比较瑞德西韦单药高出30%(OR:1.3; 95% CI:1.0,1.6; p=0.04)。
总体来说,在第29天,巴瑞替尼联合瑞德西韦的患者死亡率在数值上(35%)低于瑞德西韦单药组(5.1%: 7.8%; HR:0.65; 95% CI:0.39,1.08; p=0.09)。接受辅助供氧的患者死亡率下降更显著,第29天的死亡率在OS5和OS6亚组分别降低60%和43%。研究中未在接受巴瑞替尼用药的患者中发现新的安全性信号。NIAID作者正着手完成所有的数据分析,同行评议期刊的稿件将于近期完成。
早前研究报道(来源:蒲公英):2020年2月4日,《柳叶刀》发布通讯文章,指出巴瑞替尼(baricitinib)可以作为2019-nCoV急性呼吸系统疾病的潜在治疗方案。该研究使用了人工智能BenevolentAI的知识图,这是一种结构化医学信息的大型数据库,通过机器学习可以从科学文献中提取的众多关联信息。巴瑞替尼巴瑞替尼(baricitinib)由美国Incyte制药公司研制,是Janus(JAK1/JAK2)激酶抑制药,用于治疗自身免疫性疾病的新药。2009 年12月Incyte制药公司与Eli Lilly制药公司达成一项全球独家授权的合作协议,由Eli Lilly制药公司负责全球开发与销售权,Incyte公司只保留美国市场的共同销销权。
Eli Lilly公司于2015年第四季向欧盟、英国和日本递交新药上市申请,用于治疗中度至重度类风湿关节炎(RA)。制剂有2 mg和4 mg两种规格,2016年1月19日向美国食品药品监督管理局(FDA)提交同样申请。欧盟、英国和日本分别于2017年2月13日和2017年7月3日批准上市,商品名为Olumiant®。而美国FDA于2017年4月14日发给研发公司完全回复函,对巴瑞替尼的安全性存有疑虑,要求提供额外的临床数据来确定巴瑞替尼治疗剂量及明确巴瑞替尼治疗的安全性。Eli Lilly制药公司于2018年1月重新提交巴瑞替尼新药申请,包括新的安全性和有效性数据,并将治疗剂量确定为2 mg。美国FDA于2018年5月31日批准上市,商品名为Olumiant®。
BenevolentAI 人工智能鉴于2019年新型冠状病毒(2019-nCoV)急性呼吸道疾病的规模和迅速传播,在生产疫苗之前迫切需要可以提供帮助的药物。2019-nCoV快速测序的结果,以及基于相关病毒蛋白基因组的分子建模,已经提出了一些可能有效的化合物,包括抗HIV药物洛匹那韦(lopinavir)+利托那韦(ritonavir)的组合。
BenevolentAI是一家总部位于英国的人工智能公司。他们的使命是改变使用计算医学和AI技术设计、开发、测试和向市场投放药物的方式。它是一家具有药物发现和临床开发能力的完全整合的AI公司。该公司开发了Benevolent平台,这是一个用于药物发现的机器学习平台。BenevolentAI的知识图是结构化医学信息的大型数据库,包括通过机器学习从科学文献中提取的众多关联信息。
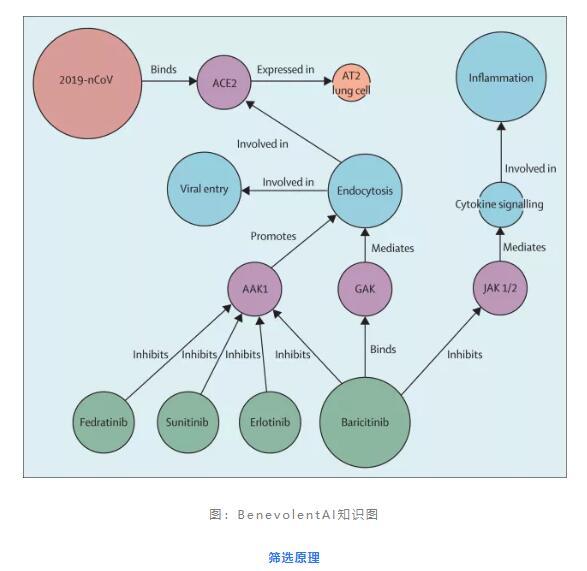
图:BenevolentAI知识图筛选原理
结合2019-nCoV定制,研究者使用BenevolentAI搜索可能有用的已批准药物,重点关注可能阻止病毒感染过程的药物。研究者筛选了巴瑞替尼,预计可降低病毒感染肺细胞的能力。
大多数病毒通过受体介导的内吞作用进入细胞。2019-nCoV用于感染肺细胞的受体可能是ACE2,它是肾脏,血管,心脏以及肺AT2肺泡上皮细胞上的细胞表面蛋白。这些AT2细胞特别容易受到病毒感染。内吞作用的已知调节剂之一是与AP2相关的蛋白激酶1(AP2-associated protein kinase, AAK1)。反过来,破坏AAK1可能会中断病毒向细胞的传递,以及病毒颗粒的细胞内组装。在知识图谱中有378种AAK1抑制剂中,有47种已被批准用于医疗用途,并且有6种AAK1具有高亲和力的抑制性。这些药物包括许多抗肿瘤药物,如舒尼替尼(sunitinib)和厄洛替尼(erlotinib),这两种药物均已显示可通过抑制AAK1来抑制细胞的病毒感染。然而,这些化合物会带来严重的副作用,研究者的数据推断高剂量才可有效抑制AAK1。研究者认为这些药物对于患病和感染的人群不是安全的疗法。相比之下,六种高亲和力AAK1结合药物之一是JAK激酶 (Janus kinase)抑制剂巴瑞替尼,它也与细胞周期蛋白G相关的激酶(内吞的另一种调节剂)结合。因为治疗性给药时,巴瑞替尼的血浆浓度(每天一次,2mg或4mg)足以抑制AAK1,所以研究者建议可以使用具有2019-nCoV急性呼吸道疾病的适当患者人群进行试验,以减少病毒的侵入和患者体内的炎症,使用终点,例如MuLBSTA评分进行确认,这是一种预测病毒性肺炎死亡率的预警模型。最后,研究者强调,与2019-nCoV爆发有关的事件正在迅速发展,希望本文提供的初步想法,可以协助全球应对疫情,但也表示早期调查和建议需要进一步详细的工作和分析,不应视为构成任何种类的医学或其他建议。
