背景及概述[1][2][3]
类风湿关节炎(rheumatoid arthritis,RA) 是一种全身性自身免疫性疾病,主要累及关节滑膜,其次为浆膜、心、肺、血管及神经等结缔组织。急性期炎症主要表现为滑膜血管水肿、滑膜炎,若未被及时诊断和治疗,滑膜中会形成血管翳,继而引起关节软骨破坏,可导致不可逆的功能性障碍。目前RA 主要采用非甾体类抗炎药物、糖皮质激素、改善病情药物(DMARDs) 等治疗。巴瑞替尼(baricitinib,商品名为Olumiant) 为Janus 激酶(JAK) 1 和JAK2 抑制剂,由礼来和因赛特制药公司研制,于2017 年2 月13 日获欧盟批准可单独或联合甲氨蝶呤用于经DMARDs 治疗效果欠佳或不能耐受的RA 患者的治疗. 巴瑞替尼对JAK1 和JAK2 具有较强的抑制作用,临床试验表明,对于RA 具有较好的疗效,且不良反应轻微,患者容易耐受,巴瑞替尼的上市为RA 的治疗提供了重要手段。巴瑞替尼除可治疗RA 外,有试验表明还可用于治疗银屑病等疾病,然而,由于巴瑞替尼刚刚上市,有关其疗效和安全性的资料尚不充分,因此,有待于开展更广泛的研究对其进行更深入地探讨。
应用[1]
KEYSTONE 等进行了一项随机双盲剂量范围Ⅱb 期研究,纳入经甲氨蝶呤治疗效果欠佳的RA 患者301 例,按2 ∶ 1 ∶ 1 ∶ 1 ∶ 1 随机分配至安慰剂组或巴瑞替尼1、2、4、8 mg·d-1 组,连续用药12 周。12 周结束后,巴瑞替尼2、4 及8 mg·d-1 组的患者按原方案继续治疗12 周; 巴瑞替尼1 mg·d-1 和安慰剂组的患者分配至巴瑞替尼2 mg(bid) 组或4 mg·d-1 组治疗12 周。主要评价指标为与安慰剂比较4 mg·d-1 组及8 mg·d-1 组患者达到ACR20 [美国风湿病学会(ACR) 规定的观察指标,达到20%的缓解的患者比例。结果发现12 周末巴瑞替尼4 mg·d-1 组和8 mg·d-1 组患者的ACR20 为76%,而安慰剂组为41%,而且在24 周末,巴瑞替尼2 mg (bid) 组、4 mg·d-1组或8 mg·d-1 组患者的ACR20 仍维持此治疗水平。在一项随机双盲安慰剂对照Ⅲ 期试验(NCT01721044)中,纳入的中、重度RA 患者在入选前曾接受常规DMARDs 治疗,但效果不明显或无效。患者随机分配至巴瑞替尼2 mg·d-1 (n =174)、巴瑞替尼4 mg·d-1 组(n = 177) 或安慰剂组(n = 176)。结果发现,在ACR20 有效率方面12周末巴瑞替尼2 mg·d-1、巴瑞替尼4 mg·d-1 组或安慰剂组分别为49%、55%和27% (与安慰剂组比较,均P ≤ 0.001),24 周末分别为45%、46%和27%(与安慰剂组比较,均P ≤ 0.001)。
一项设计与NCT01721044 相似的Ⅲ期临床试验(NCT01721057),患者被随机分配至巴瑞替尼2 mg·d-1 组(n = 229)、巴瑞替尼4 mg·d-1 组(n = 227) 或安慰剂组(n = 228)。结果发现,在ACR20 有效率方面,12 周末巴瑞替尼2 mg·d-1 组、巴瑞替尼4 mg·d-1 和安慰剂组分别为66%、62%和39% (与安慰剂组比较,均P ≤ 0.001),24 周末分别为61%、65%和42% (与安慰剂组比较,均P ≤ 0.001)。以上2 项研究表明,巴瑞替尼以2 mg·d-1 或4 mg·d-1 的剂量给药时,对RA 都有较好的治疗效果。
一项随机双盲活性药对照Ⅲ期临床试验(NCT01711359),试验纳入先前未接受过或较少接受过DMARDs 的中、重度RA 患者588 例,随机分配至单用甲氨蝶呤组、巴瑞替尼组(4 mg·d-1,po) 或巴瑞替尼联合甲氨蝶呤组(联合用药组),连续用药52 周。结果发现在ACR20 有效率方面,24 周时单用甲氨蝶呤组、巴瑞替尼组及联合用药组分别为62%、77%和78% (与单用甲氨蝶呤组比较,巴瑞替尼组和联合用药组分别为P ≤ 0.01 和P ≤ 0.001),52 周时ACR20 有效率分别为56%、73%和73% (与单用甲氨蝶呤组比较,均P ≤ 0.001)。可见巴瑞替尼治疗RA 的疗效明显优于甲氨蝶呤组。
一项随机双盲安慰剂对照Ⅲ期临床试验(NCT01710358) 中比较了巴瑞替尼与阿达木单抗的疗效。试验纳入经甲氨蝶呤治疗效果欠佳的中、重度RA 患者,患者在继续接受甲氨蝶呤治疗的基础上被随机分配至巴瑞替尼组(4 mg·d-1,po,n = 487)、阿达木单抗组(40 mg,皮下注射,隔周1 次,n = 330) 或安慰组(n =488),24 周时安慰剂组的患者转换至巴瑞替尼组,继续用药至第52 周。结果发现,在ACR20 有效率方面,12 周末巴瑞替尼组(70%) 明显高于安
慰剂组(40%,P < 0.001),在第24 周末巴瑞替尼组(74%) 也明显高于安慰剂组(37%,P≤0.001)。在第12 周末和24 周末阿达木单抗组的ACR20 有效率分别为61%和66% (与安慰剂组比较,均P 0.001)。以上结果还表明,12 周末与阿达木单抗组比较,巴瑞替尼组的ACR20 有效率明显增高(P = 0.01)。24 周末至52 周末巴瑞替尼的疗效一直维持在相似的水平。本研究表明,巴瑞替尼治疗RA 疗效明显,而且优于阿达木单抗,长期用药时也能维持满意的疗效。
药理作用 [1]
JAKs 和其下游的信号转导及转录激活蛋白(STATs) 形成了重要的细胞因子信号传导途径-JAKs- STAT 通路。在哺乳动物体内,JAK 家族有4 个成员: JAK1、JAK2、JAK3 和TYK2,其同源性达40% ~ 70%[8]。STAT 是一类能与靶基因调控区DNA 结合的胞质蛋白,是JAK 的下游底物。STAT 家族中包括STAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B 及STAT6 7 个成员。白细胞介素(IL) 类、干扰素(IFN) 类、粒细胞和巨噬细胞集落刺激因子(GM- CSF) 等多种细胞因子与其受体结合后,JAKs 可通过磷酸化作用被立即激活,然后活化的JAKs 又激活STATs,STATs 被激活后可由胞质进入细胞核,调节靶位基因的转录。在RA 患者的滑膜细胞和滑膜组织中JAKs 和STATs 水平明显升高,因此抑制JAKSTAT途径可降低炎症细胞的活化与增殖,从而缓解RA 患者的炎症反应,可见作用于JAK- STAT 途径的药物有望成为治疗RA 的重要靶点。巴瑞替尼为一选择性JAK1 和JAK2 抑制剂,对JAK1 和JAK2 有较强的抑制作用,通过酶分析发现巴瑞替尼对JAK1、JAK2、TYK2 和JAK3 的IC50分别为5.9、5.7、53 及> 400 nmol·L-1。巴瑞替尼能够抑制IFN- α、IL- 6、IL- 12 和IL- 21 诱导的STAT1、STAT3 及STAT4 的磷酸化,从而达到治疗RA 的目的。
药代动力学[1]
口服给药后巴瑞替尼吸收迅速,药物的暴露呈剂量依赖性增加,tmax为1 h,绝对生物利用度为79%,与食物同时服用时对临床疗效无明显影响。静脉给药时巴瑞替尼的分布容积为76 L,血浆蛋白结合率为50%。巴瑞替尼主要通过CYP3A4 代谢,代谢率小于10%,在血浆中检测不到代谢产物。巴瑞替尼主要通过尿液(75%) 消除,粪便消除约占20%。在RA患者中表观清除率为9.42 L·h-1,t1/2
为12.5 h。与正常肾功能患者相比,在轻、中度肾功损伤时巴瑞替尼的AUC 分别高1.41 和2.22 倍,cmax分别高1.16 倍和1.46 倍。在轻、中度肝功能损伤时,巴瑞替尼的暴露无明显影响,但未在严重肝功能损伤的患者中进行研究。
药物相互作用[1]
丙磺舒(强OAT3 抑制剂) 可使巴瑞替尼的AUC 增加约2 倍,因此当巴瑞替尼与强OAT3 抑制剂合用时应减量。来氟米特为一弱OAT3 抑制剂,与巴瑞替尼联用时应慎重。与布洛芬及双氯芬酸合用时,巴瑞替尼的暴露虽然增加,
但对临床影响不大。与环孢素(Pgp 及BCRP 抑制剂) 或甲氨蝶呤(为OATP1B1、OAT1、OAT3、BCRP、MRP2、MRP3 及MRP4 底物) 联用时,对巴瑞替尼的暴露无明显影响[6]。当巴瑞替尼(CYP3A4的底物) 与酮康唑(强CYP3A 抑制剂)、氟康唑(中等CYP3A、CYP2C19、CYP2C9 抑制剂) 或利福平(强CYP3A 诱导剂) 联用时,对巴瑞替尼的暴露也无明显影响。
不良反应[1]
RA 患者应用巴瑞替尼治疗中出现的最常见的不良反应为低密度脂蛋白升高(33.6%)、上呼吸道感染(14.7%) 及恶心(2.8%)。严重不良反应的发生率低(巴瑞替尼组为1.1%,安慰剂组为1.2%),主要表现为带状疱疹及蜂窝组织炎。对参与Ⅲ期试验、Ⅱ期试验或Ⅰb 期试验的3 463 例接受过巴瑞替尼治疗的RA 患者综合分析表明,有255 例(6.1%) 患者因不良反应中止治疗,143 例患者(3.4%) 出现带状疱疹,137 (3.2%)例患者出现严重不良反应,29 例患者(0.7%) 出现恶性肿瘤,16 例患者(0.5%) 出现心血管事件,13 例患者(0.3%) 死亡。在这些不良反应中,仅带状疱疹的发生率高于安慰剂组。
注意事项[1]
巴瑞替尼不应用于绝对粒细胞计数< 1 × 109·L-1、绝对淋巴细胞计数< 0.5 × 109·L-1 或血红蛋白< 80 g·L-1 的患者。肌酐清除率在30 ~ 60 mL·min-1 时,剂量应减半,不推荐用于肌酐清除率<30 mL·min-1 的患者。对于轻、中度肝功能不全的患者,巴瑞替尼无需调整剂量,而对于重度肝功能不全的患者应避免应用。
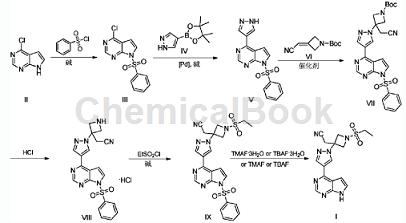
制备 [2]
巴瑞替尼的制备方法,包括如下步骤:
1)以4-氯-7H-吡咯并[2,3-d]嘧啶(II)为原料,与苯磺酰氯在碱存在下经取代反应制得中间体4-氯-7-(苯磺酰基)-7H-吡咯并[2,3-d]嘧啶(III);
2)在钯催化体系和碱存在下,中间体III与4-吡唑硼酸频哪醇酯经Suzuki偶联反应制得中间体7-(苯磺酰基)-4-(1H-吡唑-4-基)-7H-吡咯并[2,3-d]嘧啶(V);
3)中间体V与3-(氰基亚甲基)氮杂环丁烷-1-甲酸叔丁酯在催化剂存在下经迈克尔加成反应制得中间体3-(氰基甲基)-3-(4-(7-苯磺酰基)-7H-吡咯并[2,3-d]嘧啶-4- 基)-1H吡唑-1-基)氮杂环丁烷-1-甲酸叔丁酯(VII);
4)中间体VII在盐酸作用下脱除Boc保护制得中间体3-(氰基亚甲基)-3-((7-苯磺酰基)-7H-吡咯并[2,3-d]嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷盐酸盐(VIII);
5)碱存在下,中间体VIII与乙磺酰氯在有机溶剂中经磺酰胺化反应制得中间体IX;
6)中间体IX在四甲基氟化铵或四丁基氟化铵或二者的三水合物之一作用下脱除苯磺酰基保护,即得目标产物巴瑞替尼(I)。
反应方程式如下:
主要参考资料
[1] 新型治疗类风湿关节炎药物———Janus 激酶抑制剂巴瑞替尼
[2] CN201711334329.1 一种巴瑞替尼的制备方法
[3] CN201710165830.3 一种JAK抑制剂巴瑞替尼及其中间体的新合成方法
