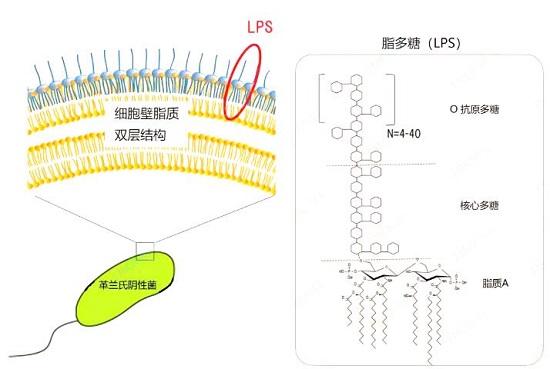
脂多糖(LPS)是革兰氏阴性细菌的主要成分,紧密结合到其细胞壁的最外层。因为其糖部分是水溶性的,而其脂质部分是脂溶性,所以LPS是两亲性物质,可溶于水和脂。
脂多糖的生物学作用
LPS在细菌正常生活状态时不释放,却通常在细菌菌体死亡破裂、人工方法裂解后或细胞活跃生长繁殖时会释放出来,其本身无毒性作用,但作为非特异性免疫原,当进入微循环后与宿主效应细胞(主要为单核细胞、巨噬细胞和中性粒细胞)相互作用分泌肿瘤坏死因子-α(TNF-α)、白细胞介素1(IL-1)、白细胞介素2(IL-2)、白细胞介素6(lL-6)、活性氧自由基(ROS)、一氧化碳(NO)等生物活性分子,引起机体发热、弥散性血管内凝血、多器官机能衰竭及休克等临床综合症。
LPS的毒性是通过LPS在细菌周围形成一层保护屏障以逃避抗生素的作用,作用于宿主细胞,产生炎性细胞因子,使机体内环境处于紊乱状态,引起内毒素血症、脓毒症等疾病。
LPS的活性
LPS具有广泛的生物学活性,不仅能激活T淋巴细胞、B淋巴细胞 、巨噬细胞 、自然杀伤细胞等免疫细胞,还能促进细胞因子生成,活化补体,对免疫系统发挥多方面的调节功能;LPS还具有免疫激活作用,能抗感染、抗辐射,增加机体免疫力,保护造血组织,并具有促白细胞增生的作用。
LPS作用机制及相关受体
当细菌侵入人体后,会释放其表面的LPS,LPS首先与脂多糖结合蛋白(LBP)相结合,LBP将LPS运送到免疫细胞的膜表面,与膜表面的蛋白质CD14相结合。随后CD14将LPS转运至Toll样受体4(Toll-like receptor,TLR4)及髓样分化蛋白2(MD2)蛋白复合体。MD2是一种特殊的外分泌蛋白,能帮助TLR4识别LPS。3种蛋白质(CD14、TLR4和MD2)的不同组合决定了TLR4对不同结构LPS的识别能力,其中跨膜蛋白TLR4起关键作用。当LPS与TLR4膜外基团结合时,其膜内基团发生构象变化,将信号转到免疫细胞内部。在细胞内部,激活髓样分化因子88、IL-1R相关蛋白激酶(IRAK)与IRAK2和肿瘤坏死因子受体活化因子6 等信号分子,通过一连串的生物化学反应,使抑制蛋白IB激酶复合体(IBkinase,IK)磷酸化,IB降解,最终活化转录因子NF-κB。NF-κB可以穿过核膜,结合在染色体上的特定区域,使某些隐性基因得以表达,产生各种多样的细胞因子。CSFs等细胞因子可以刺激免疫系统,调节免疫系统发挥功能;TNF-α、IL-1、IL-6等细胞因子却会引起炎症,导致脓毒症等严重疾病,甚至死亡。细胞因子的种类主要决定于LPS的分子结构,而细菌的传染能力与TLR4对LPS的识别能力有关,其中,LBP、CD14和TLR4是LPS的3种受体。
脂多糖水平升高的主要原因
酒精摄入量
营养不良
高脂饮食或高碳水化合物饮食
免疫细胞正在被激活(很可能是T细胞激活)
感染
肠漏
凝集素
暴饮暴食
社会隔离
吸烟
压力
脂多糖如何影响身体
导致IBD,IBS,SIBO和营养不良
当肠道受损(例如sIgA水平低)时,肠道中的LPS可促进炎症,例如,肠易激综合征(IBS)患者通常出现LPS水平增高,会进一步加剧炎症,这是由于LPS可以(在有或没有凝集素的情况下)打开肠屏障,导致肠道通透性增加。
LPS一旦通过肠道屏障(或任何屏障,即皮肤/肺),它就会进入血液并引起代谢性内毒素血症。
LPS可能是营养不良(好细菌和坏细菌之间的不平衡)和/或微生物感染的标志。
高LPS水平也可能意味着高生物膜水平,LPS水平高的人通常也具有高Th1和Th17标记。这些高水平的Th1和Th17可降低T-reg水平(T-reg对肠/口耐受具有重要意义,并有助于改善食物不耐受和发炎)。
诱发糖尿病和胰岛素抵抗
LPS诱导胰岛素抵抗,例如,LPS可增加糖尿病中的炎症,并显著增加胰岛素的分泌。
在肥胖的非糖尿病和2型糖尿病患者中,血浆LPS水平明显升高是很常见的。例如,在糖尿病患者中发现的LPS浓度高于非糖尿病患者,这是由于LPS会损害胰岛素的清除,从而加剧了胰岛素受体的信号传导。
LPS可对胰腺细胞的内质网产生压力,并可能导致它们死亡。
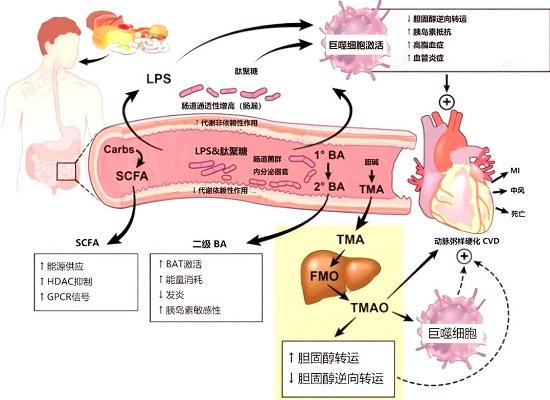
恶化动脉粥样硬化和血管系统
仅仅高脂肪饮食(如标准的西式饮食)不足以引起心脏问题。例如,以高脂肪饮食喂养的带有无菌微生物菌群的小鼠不会患上心脏病,这可能表明微生物组和LPS可能引起血管系统中出现的许多问题。
内毒素血症中的循环LPS也称为系统性炎症反应综合征(SIRS),其特征是促炎性细胞因子的过量产生以及潜在威胁生命的器官和血管功能损害。
LPS暴露会增加单核细胞上促凝血组织因子的表达,从而导致冠状动脉疾病。
LPS引起的慢性炎症可能导致心脏病发作,这是由于LPS内毒素血症会导致心脏不收缩并降低左心室压力,还可能会损害动脉并引起酸中毒。
与肥胖的关系
有研究表明,内毒素负荷增加是某些与肥胖有关的患者群体的致病原因。内毒素负荷增加是由于肠道内产生内毒素的细菌数量增加所致。其他研究表明,从大肠杆菌中纯化出的内毒素在注射入无菌模式生物后,可以诱导肥胖和胰岛素的抵抗。最近的一项研究发现,阴沟肠杆菌B29对人类患者的肥胖和胰岛素抵抗具有潜在的作用。内毒素与肥胖症相关联的推测机制是内毒素诱导炎症介导的途径。埃希氏菌属和肠杆菌属是与内毒素和肥胖相关的细菌属。
引起焦虑
LPS已显示在动物模型中可诱发焦虑。
LPS可以增加皮质醇水平。
导致抑郁
LPS已显示可在动物模型中引起快感不足和抑郁。
LPS可以通过破坏犬氨酸途径中的色氨酸而导致抑郁。
LPS可以通过降低海马和前额叶皮层中脑源性神经营养因子(BDNF)的水平来引起抑郁症。
大多数抗抑郁药对LPS具有一定的抗炎作用。
诱发脑雾
LPS通过以下几种方式引起脑雾:
葡萄糖/胰岛素失调
神经炎症
认知降低
LPS可能会抑制形成长期记忆的能力
在“卒中”起作用
LPS使脑部损伤更严重。
LPS会引起血液凝结,从而导致与高凝结因子相关的疾病(卒中)。
缺氧会使大脑中的LPS炎症恶化。
损害生殖功能
LPS可以破坏睾丸中的线粒体并损害精子的产生。
LPS暴露可能会改变卵巢的发育并导致青春期延迟,例如,在发育过程中暴露于LPS会大大延迟雌性大鼠阴道开放(VO)的时间。
通过影响体温,LPS可导致早产。
LPS可能会降低促性腺激素的分泌水平,例如促黄体生成激素(LH)和促性腺激素释放激素(GnRH),并延迟排卵。
LPS也可能降低孕激素水平。
减少线粒体和抗氧化状态
LPS已显示可导致精子细胞和骨骼肌细胞线粒体功能障碍。
慢性LPS导致谷胱甘肽耗竭。
可能引起阿尔茨海默氏病
LPS会导致神经退行性变,并可能导致阿尔茨海默氏病(AD)。在AD患者中发现了较高水平的LPS。
在AD模型中,LPS可能导致记忆障碍。
LPS可以显著诱导Tau过度磷酸化和β-淀粉样蛋白形成。
可能引起帕金森氏病
LPS 对大脑中的多巴胺有毒性作用,并引起多巴胺能神经退行性变。
帕金森氏病(PD)患者已显示出较高的LPS水平。
在多项动物研究中,LPS已显示可导致PD多巴胺功能障碍。
防止和减少LPS入侵
减轻压力
压力会打开肠道屏障,并可能导致肠渗漏。
治疗非酒精性脂肪肝病
患有非酒精性脂肪肝疾病(NAFLD)会损害肝脏清除全身LPS的能力。
饮食:低炎症性凝集素
所有食物中的凝集素都通过结合LPS和靶向TLR4来激活免疫系统。
遵循低凝集素饮食;
避免饮酒;
空腹(或不进食)显然有助于减轻肠内脂多糖的负担;
高脂饮食已显示可促进LPS内毒素血症,而Ω-3脂肪酸可减少LPS负荷。
平衡肠道菌群
食用发酵食品,如:腌鱼、乳制品、酸牛奶、泡菜、纳豆、酸菜;
增加乳酸杆菌、双歧杆菌和产生丁酸的细菌可显著帮助降低Th1 / Th17炎症水平,提高T-reg水平(包括IL-10),抑制TLR4活化并降低血浆LPS水平;
丁酸盐非常重要,因为它会阻止长链脂肪(例如来自高脂饮食)使LPS(通过乳糜微粒)穿过肠道;
补充益生元:菊粉、抗性淀粉(香蕉粉或高玉米粉)。
迷走神经刺激
增强迷走神经张力对LPS耐受性至关重要。
内源性大麻素系统
LPS刺激内源性大麻素的合成,从而调节肠道的通透性。例如,高脂饮食可以增加包括肠道在内的不同组织的内源性大麻素水平,这是高脂饮食可以增加LPS的一种方式。
激活CB2受体并抑制CB1有助于防止LPS打开肠道紧密连接的能力。
生活方式/疗法/设备
针灸;
锻炼(全身内毒素水平与体力活动呈负相关);
交感神经系统激活(冥想,呼吸运动等);
迷走神经刺激。
营养支持
黄酮类
硫辛酸
南非醉茄
虾青素
小檗碱(黄连素)
越橘
生物素
洋甘菊(芹菜素)
丁香
姜黄素
表没食子儿茶素没食子酸酯(EGCG)
鱼油(DHA,EPA和DPA)
亚麻油(α-亚麻酸)
叶酸
谷氨酰胺
绿茶
参考文献:
1. Bos MP,Robert V,Tommassen J. Biogenesis of the gram-negative bacterial outer membrane. Annu Rev Microbiol. 2007;61:191–214. doi: 10.1146/annurev.micro.61.080706.093245.
2. Kamio Y,Nikaido H. Outer membrane of Salmonella typhimurium: accessibility of phospholipid head groups to phospholipase c and cyanogen bromide activated dextran in the external medium. Biochemistry. 1976;15(12):2561–70. Epub 1976/06/15.
3. Zhang G,Meredith TC,Kahne D. On the essentiality of lipopolysaccharide to Gram-negative bacteria. Curr Opin Microbiol. 2013;16(6):779–85. doi: 10.1016/j.mib.2013.09.007. PubMed PMID: ; PMCID: PMC3974409.
4. Nikaido H. Molecular basis of bacterial outer membrane permeability revisited. Microbiology and molecular biology reviews : MMBR. 2003;67(4):593–656. doi: 10.1128/mmbr.67.4.593-656.2003. PubMed PMID: ; PMCID: PMC309051.
5. Moreno-Navarrete JM,Ortega F,Serino M,Luche E,Waget A,Pardo G,Salvador J,Ricart W,Frühbeck G,Burcelin R,Fernández-Real JM. Circulating lipopolysaccharide-binding protein(LBP) as a marker of obesity-related insulin resistance. Int J Obes(Lond). 2012,36(11): 1442–9. PMID 22184060. doi:10.1038/ijo.2011.256.
6. Sanduzzi Zamparelli,M. et al. The Metabolic Role of Gut Microbiota in the Development of Nonalcoholic Fatty Liver Disease and Cardiovascular Disease. Int. J. Mol. Sci. 17,1225(2016).
7. Vors,C. et al. Postprandial Endotoxemia Linked With Chylomicrons and Lipopolysaccharides Handling in Obese Versus Lean Men: A Lipid Dose-Effect Trial. J. Clin. Endocrinol. Metab. 100,3427–3435(2015).
8. Lassenius,M. I. et al. Bacterial endotoxin activity in human serum is associated with dyslipidemia,insulin resistance,obesity,and chronic inflammation. Diabetes Care 34,1809–15(2011).
9. Stevens BR ,Goel R ,Seungbum K ,et al . Increased human intestinal barrier permeability plasma biomarkers zonulin and FABP2 correlated with plasma LPS and altered gut microbiome in anxiety or depression. Gut 2018;67:1555.2–7.doi:10.1136/gutjnl-2017-314759
10. Xu Wang,Dong Ji,Bing Zhu,Suzhen Jiang,Lina Han,Yujie Wang,Huan Mai,Shanshan Xu,Hang Jiang,Guiqiang Wang,Yihui Rong,Contribution of endotoxin to Th17 bias in patients with non-alcoholic steatohepatitis,Microbial Pathogenesis,10.1016/j.micpath.2020.104009,(104009),(2020).
