11月29日,百时美施贵宝(BMS)宣布,美国FDA已受理该公司first-in-class 口服、选择性TYK2抑制剂deucravacitinib的新药申请(NDA),欧洲药品管理局(EMA)也已接受了deucravacitinib的上市许可申请(MAA),用于治疗成人中重度斑块型银屑病。FDA预定的PDUFA日期为2022年9月10日。deucravacitinib有望成为全球首款获批上市的TYK2抑制剂。

银屑病是一种广泛流行的、慢性、系统性免疫介导疾病,严重影响患者的身体健康、生活和工作,全球至少有1亿人受此疾病困扰。斑块型银屑病以皮肤表面明显的圆形或椭圆形斑块上覆盖有银白色鳞屑为特征。尽管现有系统性治疗能起到一定治疗效果,但仍有许多中重度银屑病患者未得到充分治疗,或未得到治疗,或者对现有疗法不满意。
TYK2是JAK家族成员之一,在介导促炎性细胞因子(包括IL-12,IL-23和I型干扰素)的信号传导中起重要作用。deucravacitinib通过选择性与TYK2蛋白调控结构域结合,使TYK2呈非活性构象,从而抑制TYK2的活性。由于TYK2的调控结构域与Janus激酶(JAK) 1、2和3的调控结构域不同,因此治疗剂量下的deucravacitinib不会抑制JAK1、JAK2或JAK3,从而避免了JAK 1-3抑制相关不良反应(AE)的发生。
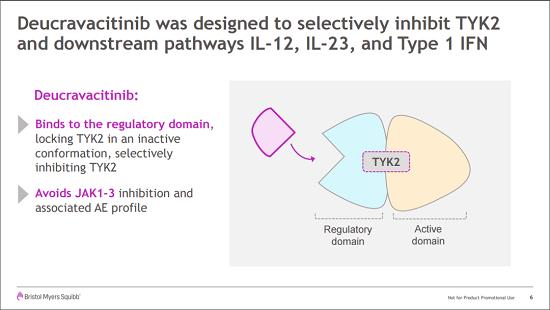
deucravacitinib的监管申请是基于关键III期POETYK PSO-1和POETYK PSO-2临床试验积极结果。两项研究均为多中心、随机、双盲对照研究,分别招募了666例和1020例中重度斑块型银屑病患者,受试者分别接受deucravacitinib (6 mg,每日1次)、安慰剂或PDE-4抑制剂阿普斯特 (30 mg,每日2次)治疗。两项研究的主要共同终点均为与安慰剂相比,第16周时达到PASI 75(银屑病面积与严重性指数评分改善75%)和sPGA 0/1(医生总体评估皮肤症状完全清除/几乎完全清除)受试者比例。关键次要终点为与阿普斯特相比,第16周时达到PASI 75和sPGA 0/1受试者比例。
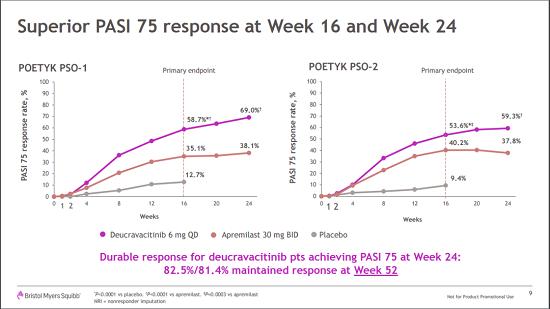
两项研究结果显示,第16周时,deucravacitinib组分别有58.7%和53.6%患者达到PASI 75,与安慰剂组和阿普斯特组相比具有显著统计学差异(p≤0.006)。并且第24周时达到PASI 75且继续接受deucravacitinib治疗患者中分别有82.5%和81.4%在第52周时仍维持PASI 75应答。
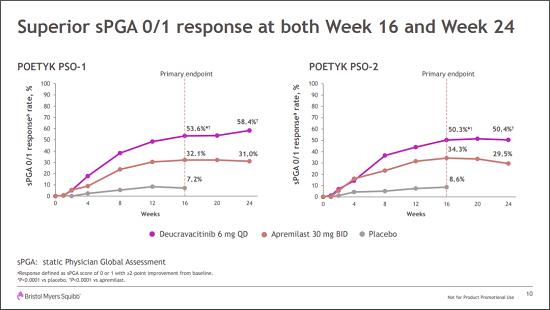
两项研究中,deucravacitinib组分别有53.6%和50.3%的患者达到sPGA 0/1,安慰剂组仅为7.2%和8.6%,阿普斯特组为32.1%和34.3%,deucravacitinib组患者皮肤症状完全清除/几乎完全清除人数与另两组相比具有显著统计学差异(p≤ 0.006)。
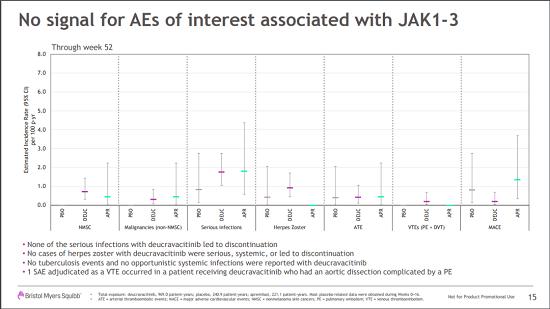
安全性方面,第16周,三组患者严重的不良事件(SAEs)发生率分别为:1.8%(deucravacitinib)、2.9%(安慰剂)和1.2%(阿普斯特),deucravacitinib组因不良反应而导致停药患者比例更低,分别为2.4%、3.8%、5.2%。并且实验室值检测结果显示,接受deucravacitinib治疗患者中没有发现与JAK1-3相关的不良反应信号。
除了被开发用于治疗银屑病外,deucravacitinib还被开发用于治疗银屑病关节炎、红斑狼疮和炎症性肠病等多种免疫性疾病。deucravacitinib用于治疗银屑病的另3项研究(POETYK PSO-3、 POETYK PSO-4、POETYK PSO-LTE)正在进行中。
