基本描述
N-甲氧羰基-L-叔亮氨酸呈白色固体,CAS号是162537-11-3,分子式是C8H15NO4,分子量是189.21,熔点是1090 °C [1],沸点是320.9±25.0 °C(Predicted),密度是1.126±0.06g/cm3(Predicted),酸度系数(pKa)为4.46±0.10(Predicted),以及折射率是1.460 [2]。N-甲氧羰基-L-叔亮氨酸溶于乙酸乙酯和甲醇,需要在密闭干燥下保存。
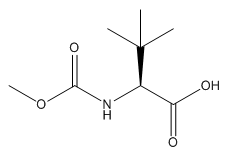
图1 N-甲氧羰基-L-叔亮氨酸的结构
制备方法
N-甲氧羰基-L-叔亮氨酸制备各的关键在于得到手性纯的L-叔亮氨酸。L-叔亮氨酸的制备方法可分为两种:拆分法和不对称合成法[3]。化学拆分法所使用的拆分剂有二苯甲酞酒石酸、奎宁或奎宁定等。生物酶因其高选择性,也可以用来拆分,但只能得到L型的叔亮氨酸。所述的方法存在一个共同的缺点就是要先制备外消旋的叔亮氨酸,将其衍生化以后,再用相应的拆分剂或者酶来拆分,价格比较昂贵,往往纯度不高,而且逍过拆分方法制备的单一构型的收率往往小于50%[4]。手性不对称合成法是比较直接的有目的地合成手性目标化合物,叔亮氨酸属于a-氨基酸的一种,对于a-氨基酸来说,经典的化学合成方法就是Strecker反应。通过氰基对亚胺的不对称加成来构筑产物的立体化学,然后经过水解等反应制备a-氨基酸。在反应的过程中,加入配体或Lewis酸,可以获得较高的选择性[5]。但是Slrecker反应的缺点是不易实现大量生产制备,而且氰基的毒性也比较大,对环境的污染比较严重[6]。生物酶法转化制备手性氨基酸化合物,不但反应条件温和,收率和光学纯度都很高,而且可以避免化学合成法引起的污染问题,具有很大的应用潜力和广阔的发展前景。
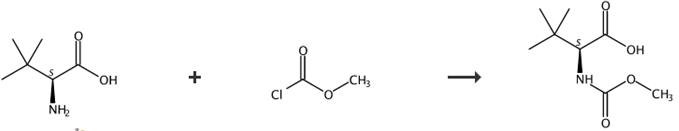
图2 N-甲氧羰基-L-叔亮氨酸的合成路线[7, 8]
(1)(2S)-2-[(甲氧羰基)氨基]-3,3-二甲基丁酸23.5 ml氯甲酸甲酯加入到2(S)-氨基-3,3-二甲基丁酸20 g的溶液中,加入252 ml 2N氢氧化钠水溶液和80 ml二氧环的混合物,反应时间为20分钟,反应溶液在60°C下加热14小时。将其冷却至室温,然后用二氯甲烷洗涤2次。水相用4N盐酸酸化至pH 2,乙酸乙酯萃取三次。将有机提取物进行组合、干燥(Na2SO4)、蒸发浓缩,产物开始凝固。固体经正己烷消化得到白色粉末的(2S)-2-[(甲氧羰基)氨基]-3,3-二甲基丁酸。熔点:106-108°C。
(2)将Na2CO3 (276 mg, 2.6 mmol)加入NaOH (5 mL 1.00 M溶液,5 mmol)和l -叔亮氨酸(656 mg, 5 mmol)的aq溶液中,用冰水浴冷却得到的溶液。向混合物中逐滴加入氯甲酸甲酯(0.42 mL, 5.4 mmol),除去冷却槽,室温搅拌3.25 h。反应混合物用乙醚(3x9 mL)洗涤,水相用冰水浴冷却,用conc HCl酸化至pH值为1-2,用CH2Cl2 (3x9 mL)提取。将有机相用硫酸镁干燥,过滤,真空浓缩,得到油状液体。然后油与甲苯(3x9 mL)共沸,最后在高真空下干燥。得到白色固体(670 mg, 71%)。(CDCl3, δ=7.26 ppm, 500 MHz): 9.57 (br s, 1H), 5.31 (d, 1H), 4.20 (d, 1H), 3.70 (s, 3H), 1.03 (s, 9H).
(3)在0 °C的D-苯甘氨酸(10.0 g, 66.1 mmol)和NaOH (21.2 g, 265 mmol)的水溶液(60 mL)溶液中,逐滴加入氯甲酸甲酯(10.2 mL, 133 mmol),持续20分钟。将得到的反应在0°C下搅拌1小时,然后用浓盐酸(25 mL, 300 mmol)酸化。用乙酸乙酯(3 × 100 mL)提取酸性溶液,组合有机物在MgSO4上干燥,过滤,真空浓缩,提供化合物,无需进一步纯化直接得到N-甲氧羰基-L-叔亮氨酸。
(4)在L-丙氨酸 (8 g, 168 mmol)的1N NaOH (168 mL)溶液中加入Na2CO3 (8.9 g, 84 mmol)。将溶液冷却至0°C,逐滴加入氯甲酸甲酯(20.5 mL, 172 mmol)。反应混合物在室温下搅拌3.5小时。溶液用Et2O洗涤,用1N HCl酸化至pH约为1。水层用DCM提取,有机层用盐水洗涤,用Na2SO4干燥,浓缩得到目标中间体N-甲氧羰基-L-叔亮氨酸。
用途
艾滋病用药Atazanavir (ATV)的中间体[9]
参考文献
[1] G. Bold, A. Fässler, H.-G. Capraro, R. Cozens, T. Klimkait, J. Lazdins, J. Mestan, B. Poncioni, J. Rösel, D. Stover, New aza-dipeptide analogues as potent and orally absorbed HIV-1 protease inhibitors: candidates for clinical development, Journal of Medicinal Chemistry 41(18) (1998) 3387-3401.
[2] J.C. Clemente, R.M. Coman, M.M. Thiaville, L.K. Janka, J.A. Jeung, S. Nukoolkarn, L. Govindasamy, M. Agbandje-McKenna, R. McKenna, W. Leelamanit, Analysis of HIV-1 CRF_01 A/E protease inhibitor resistance: structural determinants for maintaining sensitivity and developing resistance to atazanavir, Biochemistry 45(17) (2006) 5468-5477.
[3] X. Fan, Y.-L. Song, Y.-Q. Long, An efficient and practical synthesis of the hiv protease inhibitor atazanavir via a highly diastereoselective reduction approach, Organic Process Research & Development 12(1) (2008) 69-75.
[4] J.L. Martinez‐Cajas, M.A. Wainberg, Inhibitors of the Human Immunodeficiency Virus Protease, Antiviral Research: Strategies in Antiviral Drug Discovery (2009) 113-135.
[5] G.K.K. Reddy, A. Ali, M.N. Nalam, S.G. Anjum, H. Cao, R.S. Nathans, C.A. Schiffer, T.M. Rana, Design and synthesis of HIV-1 protease inhibitors incorporating oxazolidinones as P2/P2 ‘ligands in pseudosymmetric dipeptide isosteres, Journal of medicinal chemistry 50(18) (2007) 4316-4328.
[6] P. Watts, White paper: Scale out of chemical synthesis in flow reactors, Chemtrix, Burgemeester (2010).
[7] Z. Xu, J. Singh, M.D. Schwinden, B. Zheng, T.P. Kissick, B. Patel, M.J. Humora, F. Quiroz, L. Dong, D.-M. Hsieh, Process research and development for an efficient synthesis of the HIV protease inhibitor BMS-232632, Organic process research & development 6(3) (2002) 323-328.
[8] H. Zhang, S.J. Bonacorsi Jr, B.C. Chen, L.W. Leith, J. Kent Rinehart, B. Balasubramanian, J.C. Barrish, A facile and efficient synthesis of d3‐labelled Reyataz™, Journal of Labelled Compounds and Radiopharmaceuticals: The Official Journal of the International Isotope Society 48(14) (2005) 1041-1047.
[9] X. Zhang, S. Stefanick, F.J. Villani, Application of microreactor technology in process development, Organic process research & development 8(3) (2004) 455-460.
