低血压是休克的关键特征,与多系统器官衰竭的发展密切相关。多项研究强调,即使是短暂的低血压也是有害的[1,2]。在对33,000名非心脏手术患者的回顾性分析中,Walsh等研究显示短时间的术中低血压与急性肾损伤(AKI)、心肌损伤或心脏并发症及病死率的风险显著增加相关[1]。肾脏和心脏损伤的风险随着低血压持续时间的增加而增加,并且在1-5分钟的短时间内最为显著。同样,Salmasi等基于超过57,000名接受非心脏手术患者的数据显示,术中平均动脉压(MAP)低于65 mmHg的患者心肌损伤和AKI发生风险显著增高,这证实了低血压不需要低至严重程度就可以影响器官功能[2]。
在这些研究和其他研究的基础上,欧洲和国际治疗休克的指南建议,应始终能满足最低限度的MAP,目标应至少为65 mmHg [3,4]。迄今为止,MAP的恢复和维持是通过合理使用液体以及血管加压药,即儿茶酚胺和加压素类似物来实现的。 然而,脓毒症患者对于传统给予的治疗常常表现出明显的低反应性。迄今为止,没有任何血管加压药在临床结果方面被证明优于其他药物[5-7]。 2015年,一项荟萃分析得出的结论认为,除了去甲肾上腺素优于多巴酚丁胺的存活率之外,没有充分的证据推荐任何血管加压药或其他药物组合[8]。
血管紧张素II(Ang II)已成为血管舒张性休克患者提升血压的有效疗法[9]。休克患者给予 血管紧张素 II的首次报道可追溯到50年前,但在几项小型研究和最近进行的一项更大规模的随机对照试验(RCT)后,对其兴趣重新点燃,确认血管紧张素II有效维持MAP 目标和减少去甲肾上腺素的要求,而且不增加不良反应[9-11]。 以下综述概述了血管紧张素的生理效应并总结了文献中的现有数据。
肾素-血管紧张素系统的作用
在1898年发现肾素后,血管紧张素原和血管紧张素转换酶(ACE)后来被确定为经典肾素 - 血管紧张素循环系统(RAS)的关键成分[12,13]。 血管紧张素原是血管紧张素的前体,是一种主要由肝脏产生的α-糖蛋白,并释放到全身循环中,并在肾素活性作用下转变为血管紧张素I(AngI)(图1)。 血管紧张素 I主要通过肺内的内皮细胞结合ACE裂解成血管紧张素Ⅱ,但也在血浆、肾脏、心脏与脑的血管床中转换,并且在某种程度上还通过储存在肥大细胞分泌颗粒中的糜蛋白酶进行裂解[13,14]。
肾素是肾小球旁器(也称球旁复合体)的球旁颗粒细胞释放的一种蛋白水解酶,它被储存在细胞内囊泡中,并且响应于三种刺激而迅速分泌:压力反应器检测到的血压降低,远端小管的钠浓度降低以及交感神经系统激活(通过β1肾上腺能受体)。肾素本身没有外周受体,也没有直接的血流动力学效应[14]。
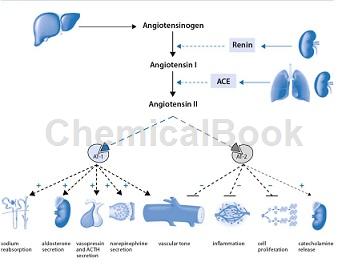
血管紧张素II的作用
血管紧张素II通过结合基于各种类型细胞的膜特异性血管紧张素(AT)受体发作作用,如AT-1,AT-2,AT-4和Mas受体。在人体中,主要的生理作用是由位于肾脏、血管平滑肌、肺、心脏、脑、肾上腺、垂体及肝脏的AT-1受体介导的,并且与维持血流动力学稳定性、液体与电解质调节有关([14,16];图1和表1)。
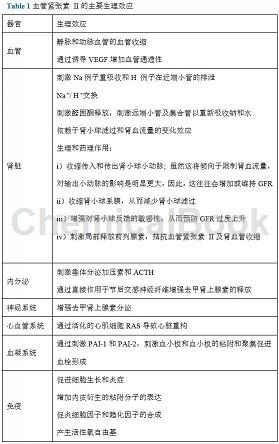
在健康成人中,AT-2受体在某些细胞类型和组织中表达,如血管内皮细胞,脑的不同区域,肾上腺,子宫肌层和卵巢以及比分皮肤,肾及心脏[17, 18]。虽然它们的表达水平通常比AT-1受体低得多,但AT-2受体在损伤和修复机制中具有重要作用,并且在诸如机械损伤或局部缺血的条件下,表达可能增加。还有很好的证据表明AT-2受体参与了血管紧张素II介导的肾上腺儿茶酚胺分泌的调节,例如在脓毒症期间[18]。
AT-2受体的主要生物学作用通常与AT-1受体相反,重点在于抗增殖,血管舒张和抗炎作用。刺激AT-2受体可以防止AT-1受体的过度刺激:例如,AT-1受体介导的血管收缩可以被与AT-2受体结合的血管紧张素II的血管舒张作用所抵消([19],图1)。 AT-2受体还在压力性利钠、对抗AT-1受体激活的抗利钠作用及心肌梗死、高血压、心力衰竭、中风后的心血管重构中发挥作用。最后,在胎儿和新生儿中,AT-2受体参与胎儿组织发育,神经元再生及细胞分化。AT-4受体被血管紧张素 II代谢物紧张素 IV激活,似乎有助于调节中枢神经系统中的细胞外基质,以及调节催产素释放。
脓毒症诱导的肾素-血管紧张素系统失调
RAS的生理作用是保持血管内容量状态和动脉血压,从而维持体循环和微循环。在脓毒症中,RAS的上调与下调均已被报道过[20-25]。ACE的功能和血管紧张素受体的功能是血流动力学稳定性是否可以实现和维持的关键因素。
ACE是一种细胞外酶,主要分布在肺毛细血管内皮细胞上,也分布在血管内皮和肾上皮细胞中。 ACE分子沿着肺内皮管腔表面均匀分布[26]。因此,ACE可以直接接触血源性底物,并能够迅速将血管紧张素 I转化为血管紧张素 II,但对于肺血管系统的疾病过程的影响也非常敏感[27]。
脓毒症对血管紧张素II水平的影响
在脓毒症期间,肾素,血管紧张素 I及血管紧张素II通常被激活。 然而,血管紧张素Ⅱ的血浆水平不稳定甚至会降低[20,21],其原因是多方面的。 预防性使用ACE抑制剂将防止血管紧张素I转化为血管紧张素II。 也有证据表明与革兰氏阴性脓毒症相关的内毒素有可能使ACE失活[22]。 此外,在影响肺毛细血管内皮的疾病如急性呼吸窘迫综合征(ARDS)及肺炎中,ACE活性在早期发生改变,导致血管紧张素I转化为血管紧张素II的能力下降[23,28-30。
低水平的血管紧张素II和ACE具有临床意义。 Zhang等人 测量了58例严重脓毒症患者的连续血管紧张素II和ACE浓度,结果显示低水平的队列中表现出更多的并发症和更大的死亡风险[20]。
脓毒症诱导的血管紧张素II受体下调
血管紧张素II受内源性血管扩张剂一氧化氮(NO)的拮抗,并且会互相影响产生和功能。 几项研究表明,脓毒症与AT-1受体的下调有关,可能是由促炎细胞因子和NO介导的[31,32]。 此外,已报道AT-1受体活性下降与蛋白1(Arap 1)有关[33]。 Arap 1的生理作用是支持AT-1受体向细胞膜的运输。因此,Arap1的活性降低与AT-1受体的敏感性降低有关。
AT-2受体下调也可能在感染性休克期间发生[18]。 这一过程的后果是肾上腺髓质释放儿茶酚胺减少,对儿茶酚胺反应减弱和醛固酮形成减少。
血管紧张素的临床研究
血管紧张素II是20世纪30年代发现的,自20世纪60年代初以来一直用于临床研究。 迄今为止,已有超过31,000名受试者暴露于血管紧张素II,作为单药治疗或与儿茶酚胺和非儿茶酚胺类血管加压药物联合用于各种临床场景中[34]。
A. 产科麻醉中低血压的预防
低血压是脊髓麻醉期间常见的不良反应。 子宫胎盘血流直接依赖于母体血压,而中度母体低血压与胎儿低氧血症与神经系统疾病相关,在这部分产科患者中,我们都试图在预防低血压[35]。 去氧肾上腺素和麻黄碱经常用于临床实践。 麻黄碱是产科麻醉多年来首选的血管加压药,因为其显著增加子宫胎盘血流[36]。 然而,由于其可能导致胎儿代谢活性增加而致较低的脐动脉pH值[37],从而逐渐退出历史舞台。
去氧肾上腺素是一种合成的拟交感神经药,被认为在局部麻醉引起的母亲低血压治疗中是安全的[35]。
与其他全身血管相比,血管紧张素Ⅱ引起子宫胎盘血管床的血管收缩更少[38,39]。 1994年,Ramin等人将30名接受剖宫产的健康孕妇随机分为对照组、预防性血管紧张素II输注、预防性麻黄碱输注,以保持舒张压高于基线0-10mmHg [40]。在随机接受血管紧张素II输注的女性中,母体血管紧张素II水平增加将近四倍,但脐动脉和静脉中的血管紧张素II水平未改变。值得注意的是,在血管紧张素II队列中,没有发现脐动脉血pH <7.20,而麻黄素组的达40%,差别较为明显。 Vincent等人在腰麻剖宫产术中,54名随机接受血管紧张素II与麻黄素治疗的女性报道了类似的结果[41]。血管紧张素组的脐动、静脉pH和碱剩余较麻黄碱组高,麻黄碱组孕妇心率也较高。作者总结认为,血管紧张素II在麻醉期间维持了收缩压,而不引起胎儿酸中毒和增加孕妇心率。
B. ACE抑制剂过量后低血压的治疗
ACE抑制剂过量可导致严重的难治性低血压。 有几篇病例报道使用血管紧张素II的成功治疗[42-44]。 虽然在所有情况下,血管紧张素II与其他治疗方法联合使用,包括肠道净化,静脉输液,血管加压药和纳洛酮,但输注血管紧张素II后立即对血压产生了明显的影响。在生理学上讲,将血管紧张素II视为ACE抑制剂引起的低血压的治疗是合理的。
C. 治疗血管舒张性休克
血管舒张性休克患者的最直接和最关键的需求是实现血流动力学稳定性以预防多器官功能障碍,同时允许时间来治疗原发病。通常需要多种血管加压药和儿茶酚胺[45]。 使用血管紧张素II作为血管加压药治疗休克的研究最初是在20世纪60年代进行的。 血管紧张素II与儿茶酚胺在非随机设计中进行比较,并显示出与去甲肾上腺素相似的作用[46,47]。
在个RCT中,Chawla等人报道用血管紧张素II给药治疗对儿茶酚胺敏感性不佳的高输出量休克有效[10]。随后的血管紧张素治疗高输出量休克(ATHOS)-3试验的是一项3期的安慰剂对照,双盲,多中心的随机对照试验,包括321例难治性血管扩张性休克患者,随机分配到血管紧张素II输注组和安慰剂组[9]。主要疗效终点分析(定义为实现预定目标血压反应的患者百分比)具有统计学意义(p <0.0001)。 158名接受安慰剂治疗的患者中有23%具有所需的血压反应,血管紧张素II治疗的163名患者中有70%,血管加压素II治疗导致血管加压药使用量的下降(对比48小时心血管SOFA变化:1.75:1.28,p = 0.01)。虽然病死率无差异,但血管加压素II的不良事件更少。在最近一次系统评价中,包括来自超过31,000名患者的数据,Busse等人的报道也证实血管加压素II可安全地用于人体[34]。
结论
RAS轴在维持血流动力学稳定性,血管紧张度及电解质平衡方面起着关键作用。研究表明其生理调节在脓毒症和危重疾病中受到影响,导致ACE功能改变,血管紧张素II生成减少和受体下调。 最近的随机对照试验显示,血管紧张素Ⅱ可有效安全地治疗难治性血管舒张性休克患者的低血压症状,从而可以减少儿茶酚胺用量。它也可能在心源性、其他分布性及多种性质休克中也起作用[48]。
人体天然存在三种分子来维持和调节血压,即儿茶酚胺,血管加压素及血管紧张素。 血管紧张素II作为抗休克的一种潜在药物,为临床医生提供了一种为血管加压药治疗提供“平衡”方法的机会。 不同的血管活性药物联合使用,可以模拟人体对严重血管舒张和低血压的自然反应,这使得它们具有生理性的意义[49]。 采用这种方法,血流动力学恢复的可能性增加,大剂量单药治疗的毒性可以降至最低。
来源:急诊医学资讯
