Valeriansure Chemische Eigenschaften,Einsatz,Produktion Methoden
ERSCHEINUNGSBILD
FARBLOSE FLüSSIGKEIT MIT CHARAKTERISTISCHEM GERUCH.
PHYSIKALISCHE GEFAHREN
Die Dämpfe sind schwerer als Luft.
CHEMISCHE GEFAHREN
Schwache Säure.
ARBEITSPLATZGRENZWERTE
TLV nicht festgelegt (ACGIH 2005).
MAK nicht festgelegt (DFG 2005).
AUFNAHMEWEGE
Aufnahme in den Körper durch Inhalation und durch Verschlucken.
INHALATIONSGEFAHREN
Nur ungenügende Angaben vorhanden über die Geschwindigkeit, mit der eine gesundheitsschädliche Konzentration in der Luft beim Verdampfen bei 20°C erreicht wird.
WIRKUNGEN BEI KURZZEITEXPOSITION
WIRKUNGEN BEI KURZZEITEXPOSITION: Die Substanz verätzt die Augen, die Haut und die Atemwege. ätzend beim Verschlucken.
Beschreibung
Farblose, übelriechende Flüssigkeit; Siedepunkt: 184-187 ℃; Schmelzpunkt: -34 ℃; n
20D: 1.4085; schlecht löslich in Wasser, gut in Ethanol und Ether. Valeriansäure kommt in der Natur vor allem in Baldrianen (Valeriana) zusammen mit der isomeren Isovaleriansäure (3-Methylbutansäure) vor. Weiterhin ist sie Bestandteil der Duftmarke verschiedener Säugetiere und kommt in geringen Spuren in einer Reihe von Lebensmitteln, wie Käse, sowie im Magen von Wiederkäuern vor. Die technische Synthese von Valeriansäure erfolgt aus But-1-en durch Hydroformylierung zu Pentanal und anschließende Oxidation zur Carbonsäure. Valeriansäure wird hauptsächlich zur Herstellung ihrer Salze und Ester eingesetzt. Die Natrium- und Calciumsalze dienen als Rotentizide und Fungizide. Die durch Veresterung mit aliphatischen Alkoholen gewonnenen Valerate werden als Duftstoffe und künstliche Aromen verwendet. Die durch Veresterung mit Glycolen und Polyolen gewonnenen Verbindungen dienen als Schmierstoffe.
Synthese
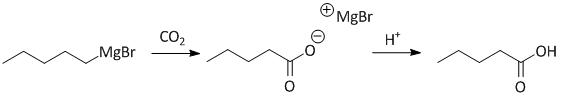
In einem 1 L Dreihalskolben werden 12.2 g Magnesiumspäne, ein winziger Kristall Iod und 170 ml über Natrium getrockneter Ether vorgelegt. Der Kolben wird mit Rückflusskühler (Trockenrohr!), Thermometer und Tropftrichter ausgestattet. In den Tropftrichter füllt man eine Mischung von 54 ml 1-Butylbromid in 90 ml wasserfreiem Ether. Zuerst lässt man unter Rühren 10-15 ml der Lösung in den Kolben laufen und wartet, bis die Reaktion anspringt. Der Rest wird anschließend unter Kühlung im Eisbad so hinzugetropft, dass die Mischung stets gelinde siedet. Nachdem alles Butylbromid hinzugegeben wurde, wird der Kolben aus dem Eisbad genommen und für 15 Minuten bei Raumtemperatur gerührt (fast alles Magnesium sollte sich zu diesem Zeitpunkt aufgelöst haben). Anschließend wird das Reaktionsgemisch in einer Eis-Kochsalz Kältemischung (-20 ℃) gekühlt. Der Tropftrichter wird durch ein Gaseinleitungsrohr ersetzt und es wird mit Schwefelsäure getrocknetes (2 Waschflaschen mit Schwefelsäure) Kohlenstoffdioxid (aus einer Bombe) so eingeleitet, dass die Temperatur nicht über -5 ℃ steigt (das Gaseinleitungsrohr muss nicht in das Reaktionsgemisch eintauchen). Das Ende der Reaktion macht sich dadurch bemerkbar, dass die Temperatur auch dann, wenn man den CO2-Strom erhöht, nicht weiter ansteigt, sondern abfällt. Nachdem die Reaktion vorüber ist, wird das Reaktionsgemisch durch Zugabe von 300 ml Wasser und 75 ml konzentrierter Salzsäure hydrolysiert. Die Ether-Phase wird anschließend abgetrennt und die wässrige Phase 3 Mal mit 50 ml Ether extrahiert. Die vereinigten Etherphasen werden mit Eis versetzt und 1 Mal mit 100 ml und dann mit 50 ml 25%-iger Natronlauge extrahiert (mit Phenolphtalein prüfen, ob die wässrige Phase basisch reagiert). Die vereinigten wässrigen Phasen (enthalten das Natriumsalz der Valeriansäure) werden anschließend der Destillation unterworfen, wobei etwa 10% des Volumens abdestilliert werden um Etherreste und andere flüchtige Verbindungen zu entfernen (Destillat wird verworfen). Die Lösung wird abkühlen gelassen und danach mit konzentrierter Salzsäure angesäuert. Hierbei scheidet sich die Valeriansäure als obere, organische Phase ab. Die Valeriansäure wird abgetrennt und die wässrige Phase der Destillation unterworfen, bis sich keine öligen Tropfen mehr in der Vorlage abscheiden. Man gewinnt so eine weitere Fraktion Valeriansäure. Die vereinigten organischen Phasen werden mit wasserfreiem Natriumsulfat getrocknet und destilliert. Die reine Valeriansäure geht bei 182-185 ℃ über.
LECKAGE
Ausgelaufene Flüssigkeit in abgedeckten Behältern sammeln. Verschüttete Flüssigkeit mit viel Wasser wegspülen. NICHT in die Umwelt gelangen lassen.
R-Sätze Betriebsanweisung:
R34:Verursacht Verätzungen.
R52/53:Schädlich für Wasserorganismen, kann in Gewässern längerfristig schädliche Wirkungen haben.
S-Sätze Betriebsanweisung:
S26:Bei Berührung mit den Augen sofort gründlich mit Wasser abspülen und Arzt konsultieren.
S36:DE: Bei der Arbeit geeignete Schutzkleidung tragen.
S45:Bei Unfall oder Unwohlsein sofort Arzt zuziehen (wenn möglich, dieses Etikett vorzeigen).
S61:Freisetzung in die Umwelt vermeiden. Besondere Anweisungen einholen/Sicherheitsdatenblatt zu Rate ziehen.
Beschreibung
Valeric acid, or pentanoic acid, is a straight - chain alkyl carboxylic acid with the chemical formula C
5H
10O
2. Like other lowmolecular- weight carboxylic acids, it has a very unpleasant odor. It is found naturally in the perennial flowering plant valerian (Valeriana officinalis), from which it gets its name. Its primary use is in the synthesis of its esters. Volatile esters of valeric acid tend to have pleasant odors and are used in perfumes and cosmetics. Ethyl valerate and pentyl valerate are used as food additives because of their fruity flavors.
Valeric acid appears similar in structure to GHB and the neurotransmitter GABA in that it is a short-chain carboxylic acid, although it lacks the alcohol and amine functional groups that contribute to the biological activities of GHB and GABA, respectively. It differs from valproic acid simply by lacking a 3- carbon side - chain.
Chemische Eigenschaften
Valeric acid has an unpleasant odor and flavor, similar to butyric acid. May consist of one or a mixture of isomers of
n-pentanoic acid and/or 2- or 3-methyl-butanoic acid.
Occurrence
The acid is not too common in nature; reported (as the corresponding ester) found in the essential oil of Boronia
anemonifolia, in pineapple fruits and in other plants; also identified as acid or the corresponding ester in the essential oil of lemon petitgrain.
Also reported found in apple, apple juice, banana, orange juice, bilberry, cranberry, strawberry, raspberry, papaya, grapes, celery,
onion, baked potato, tomato, corn mint oil, breads, cheeses, milk, yogurt, butter, cheddar cheese, lean and fatty fish, fish oil, cooked
meats, hop oil, beer, rum, whiskies, grape wines, cocoa, tea, roasted filberts, peanuts and pecans, honey, soybeans, coconut meat and
milk, cloudberry, passion fruit, starfruit, trassi, mango, jackfruit, licorice, calamus, sake, buckwheat, watercress, laurel, peated malt,
wort, kiwifruit, loquat, Bourbon vanilla, shrimps, oyster, scallop, cape gooseberry, sea buckthorn, Chinese quince and maté.
Verwenden
valeric acid is obtained from valerian extract, which is considered skin conditioning.
Definition
ChEBI: A straight-chain saturated fatty acid containing five carbon atoms.
synthetische
By oxidation of n-amyl alcohol or, together with other isomers, by distillation of valerian roots; also by reacting butyl
bromide and sodium cyanide with subsequent saponification of the formed butyl nitrile.
Allgemeine Beschreibung
A colorless liquid with a penetrating unpleasant odor. Density 0.94 g / cm3. Freezing point -93.2°F (-34°C). Boiling point 365.7°F (185.4°C). Flash point 192°F (88.9°F). Corrosive to metals and tissue.
Air & Water Reaktionen
Water soluble.
Reaktivität anzeigen
Valeric acid is a carboxylic acid. Exothermically neutralizes bases, both organic and inorganic, producing water and a salt. Can react with active metals to form gaseous hydrogen and a metal salt. Reacts with cyanide salts to generate gaseous hydrogen cyanide. Flammable and/or toxic gases and heat are generated by reaction with diazo compounds, dithiocarbamates, isocyanates, mercaptans, nitrides, and sulfides. Reacts with sulfites, nitrites, thiosulfates and dithionites to generate flammable and/or toxic gases and heat. Reacts with carbonates and bicarbonates to generate a harmless gas (carbon dioxide) but still heat. Can be oxidized by strong oxidizing agents and reduced by strong reducing agents. These reactions generate heat. May initiate polymerization reactions. May catalyze (increase the rate of) chemical reactions.
Health Hazard
Corrosive. Very destructive to tissues of the mucous membranes, upper respiratory tract, eyes, and skin. Symptoms may include burning sensation, coughing, wheezing, laryngitis, shortness of breath, nausea and vomiting. Extremely destructive to skin. May be absorbed through the skin.
Brandgefahr
Special Hazards of Combustion Products: Irritating vapors and toxic gases, such as carbon dioxide and carbon monoxide, may be formed when involved in fire.
Sicherheitsprofil
Moderately toxic by
ingestion, intravenous, and subcutaneous
routes. Mildly toxic by inhalation. A
corrosive irritant to skin, eyes, and mucous
membranes. Combustible liquid. When
heated to decomposition it emits acrid
smoke and irritating fumes. Used in
perfumes.
läuterung methode
Water is removed from the acid by distillation using a Vigreux column (p 11), until the boiling point reaches 183o. A few crystals of KMnO4 are added, and after refluxing, the distillation is continued. [Andrews & Keefer J Am Chem Soc 83 3708 1961, Beilstein 2 H 299, 2 I 130, 2 II 263, 2 III 663, 2 IV 868.]
Valeriansure Upstream-Materialien And Downstream Produkte
Upstream-Materialien
Downstream Produkte

