人纤维蛋白原(Fgrinogen,Fg)是血浆中最早分离出来的一种蛋白质,由肝脏合成。是大分子的可溶性糖蛋白,分子量330 000~340 000,等电点5.5,沉降常数7.7~7.9。其分子为一个二聚体,呈长条状,长度50~60nm,含有三对多肽链(Aα2、Bβ2、γ2),由二硫键连接。三条多肽链分别由三条独立mRNA 转录,这三条基因相连成簇,均为不连续单一拷贝基因,它们共同位于第4 号染色体长臂q23~q32不到50kb 的核苷酸上。纤维蛋白原共含有19种氨基酸,其中天门冬氨酸和谷氨酸等酸性氨基酸含量较多,各占分子量的13.1%和14.5%。纤维蛋白原在溶液中带负电荷,一旦失去这些酸性基团,则有利于聚合。大量的文献表明,纤维蛋白原水平的变化不仅与凝血障碍、出血性疾病、弥漫性血管内凝血(DIC)、应激等有关,而且与冠心病(CHD)、心肌梗死(AMI)、脑血管病等有关,因而纤维蛋白原研究倍受关注。
Fg蛋白结构
纤维蛋白原是一种含2964个氨基酸的大分子糖蛋白,相对分子质量为340×103,首先在肝细胞中合成,由两个相同的组分(Aα,Ββ,γ)2组成六聚体,链间以二硫键相连。Aα,Ββ,γ三条多肽链借助AαCys28、γCys8和Cys9构成对称性二聚体。单体中AαCys36与另一单体ΒβCys65组成的二硫键对形成二聚体分子也起到关键作用。Aα、Ββ、γ三条多肽链相对分子质量分别为66 ×103、52 ×103 和46 ×103,并分别由610个、461个和411个氨基酸残基组成。三条链在肝脏由独立的多核糖体合成其前体蛋白(分别包括19、30、26个信号肽),在粗面内质网内将信号肽切除、疏水反应及二硫键形成等加工后,折叠、装配成成熟的二聚体分子,最后经糖基化、部分磷酸化分泌到胞外。
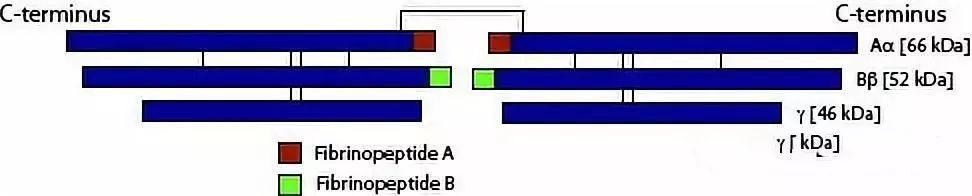
在成熟的纤维蛋白原二聚体分子中,中央区(E区)由6条多肽链的氨基端组成,形成二硫键结;两个外围区(D区)由Ββ和γ链的羧基端组成,而Aα链的羧基端折回参与E区结构。E区和D区之间由带状结构(coiled-coil)相连,coiled-coil区为Aα、Ββ、γ三链形成的α-螺旋结构,大约由110个氨基酸残基组成,coiled-coil区两端的二硫键对纤维蛋白原分子成熟二聚体结构的形成至关重要。coiled-coil区近氨基端部分的缺失对杂聚体和半分子的形成几乎没有影响,但会阻止半分子形成成熟的六链分子;相反此区远氨基端部分的缺失则会完全终止装配过程。用幼鼠肾细胞株(BHK)转染实验显示,纤维蛋白原的起始装配包括αγ和βγ杂聚体的形成,但不包括αβ杂聚体,第三条链的加入导致半分子αβγ的形成,而后二聚化形成成熟的六链的纤维蛋白原,参与血液循环。
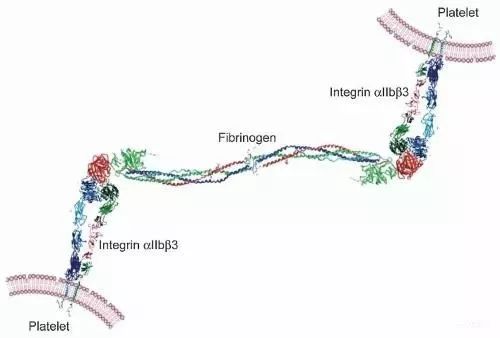
纤维蛋白原分子中,有多个配体的结合位点,研究较多的是凝血酶作用位点和血小板糖蛋白IIb/IIIa的结合位点。凝血酶的裂解位点在Aα-16和Ββ-14作用后分别释放出纤维蛋白肽A和B,并同时分别形成纤维蛋白单体Ⅰ和Ⅱ。研究发现,Fg中有多个糖蛋白Ⅱb/Ⅲa的结合序列,主要是α95~97、α572~574的RGD序列和γ400~411附近的10~15个氨基酸残基;并且两个多肽会相互抑制,说明两者在糖蛋白上的结合位点可能相同,也或是前者结合后导致糖蛋白构型的改变,而阻止另一种多肽的再次结合。其中γ400~411是血小板聚集的关键,α链的RGD序列则不是必需的。由于Fg的3条多肽链是独立合成的,在成熟之前要经过加工和装配;每条多肽链的部分氨基酸的改变都可能影响这些过程,使3条多肽链不能装配成完整的Fg 分子。除了前述的二硫键的重要作用外,β 链的合成是装配的限速步骤,特别是Ββ73~93之间是装配所必需的;γ链的羧基末端氨基酸143~411,特别是γ387 也是关键。
FG在血管疾病中的意义
FG为重要的凝血因子,越来越多的研究表明高纤维蛋白原水平导致高凝状态,诱发血管疾病造成缺血性损伤。国外学者提出脑梗死发生之前降低FG水平,减少血栓形成的前体物质,阻断异常凝血过程,降低脑梗死的发生率。Knuiman等研究发现,FG 水平增高与脑梗死有密切的关系,并且FG的水平直接影响到卒中的严重程度,在12%的不可逆型、16%的进展型、85%的完全卒中型,FG 水平>4g/L。
FG在肿瘤疾病中的意义
血浆FG分解形成纤维蛋白,为癌细胞的生长、浸润和转移提供支架,FG亦可以作为不同的黏附分子的配体,增加PLT及肿瘤细胞间的黏附结合,促进肿瘤细胞的浸润和转移,PLT附着肿瘤细胞的表面,形成瘤栓阻碍免疫细胞攻击肿瘤细胞;鳞状细胞癌能刺激肝细胞产生大量的FG;恶性肿瘤与凝血功能的改变有密切的关系,肿瘤细胞通过组织因子或其他促凝因子激活FG,为肿瘤细胞转移提供有利的条件,因此FG对肿瘤细胞的生长、浸润、转移具有重要的价值。
FG在糖尿病中的意义
大量研究表明,糖尿病患者体内存在凝血、纤溶功能及血小板活性异常,呈血液高凝状态,患者血浆FG水平会明显升高。主要原因可能有:血液中纤溶活性的调节主要取决于内皮细胞分泌纤溶酶原激活物(t-PA)与纤溶酶原激活物抑制剂(PAI-1)的相对比例,血小板α颗粒中富含PAI-1,而且3/4储存于血小板中,抑制纤溶酶原激活剂的活性,使血浆中纤维蛋白浓度增高。此外,血浆中的一些脂蛋白与纤溶酶原激活剂竞争结合FG,从而抑制纤溶酶的活性,FG 水平增高。
FG在其他疾病中的意义
FG是肝脏合成的重要凝血因子,严重的肝脏疾病尤其是慢性乙肝患者,其肝功能严重受损,FG 合成量下降,因此FG的水平有助于准确判断肝病的病情、评估预后、指导治疗。当机体发生炎症时,血液处于高凝状态,部分凝血指标会明显升高,其中FG主要通过白细胞表面的受体与白细胞相互作用而参与炎症过程。因此在治疗过程中适当降低FG的水平对控制病情是有益的。
纤维蛋白原水平测定
血浆中纤维蛋白原生理含量为2.0~4.0g/L,该水平具有生理和病理双重作用。一方面保证在凝血最后一步,有足量的纤维蛋白原聚合成不可溶性纤维蛋白,另一方面又影响了血浆和血液粘滞度。纤维蛋白原水平受外伤、炎症、妊娠、肥胖、吸烟等影响,也受遗传因素影响。并随着年龄的增长呈进行性增高。
纤维蛋白原水平的测定也有助于缺血性心血管疾病的危险度判断。目前纤维蛋白原测定方法颇多,大体有三类,类功能测定法,即在血浆中加入凝血酶后测定所形成的纤维蛋白量或凝固时间。该类方法中Jocobsson 法为世界卫生组织(WHO)和美国国家临床检验标准委员会(NIBCC)推荐的参考方法,von Clauss 法为国外常规方法。该类方法测定的是有凝血功能的纤维蛋白原,因此最能直接反映血浆中具有凝血功能纤维蛋白原水平,所以特异性好;第二类物理化学法,主要通过盐析沉淀、热变性沉淀、电泳等测定纤维蛋白原,该类方法多数比较简单、快速,但是特异性不高,所测定纤维蛋白原不仅包括可凝固纤维蛋白原,而且含有异常纤维蛋白原(无凝固功能)和纤维蛋白降解产物和/或其它蛋白,其中有的方法精密度差,影响因素多;第三类免疫测定法,用抗纤维蛋白原多克隆抗体或单克隆抗体测定纤维蛋白原,该类方法大部分比较简单,缺点是因与纤维蛋白降解产物和异常纤维蛋白有共同抗原,而特异性不高。
纤维蛋白原亚组份测定
血浆纤维蛋白原亚组份测定自70年代已受到临床的重视。由于纤维蛋白原分子Aα链的异质性,血浆纤维蛋白原可被十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分为高分子组份纤维蛋白原(HMW、MW340 000)、低分子组份纤维蛋白原(LMW、MW300 000)和低分子′组份纤维蛋白原(LMW′、MW280 000)。一般认为,HMW 是纤维蛋白原的主要成分,而LMW 和LMW′是其降解产物,HMW 较LMW 和LMW′易凝固、易聚合和不易溶解于水。这种差异的生理意义在于外伤、应激时HMW 的增加,有利于机体保护。但病理状态时,如DIC等早期,当纤维蛋白原总量尚未改变,HMW/LMW 可能已有变化,可提示血液有高凝倾向;而AMI 早期是因为HMW 合成增加使纤维蛋白原明显升高,所以HMW 增高可作为早期诊断AMI 的指标;但CHD 中则是以LMW 增高为主,因此LMW在CHD 发病中起关键性作用;另外在某些血栓病中存在有HMW明显高于LMW 现象。通过123 例1~93 岁健康人纤维蛋白原亚组份分析可知,人群中有随年龄增加血浆HMW 水平逐渐下降,而LMW 水平逐渐升高的倾向。这与CHD 发病率随年龄增高而升高趋势有一致性,表明纤维蛋白原亚组份的改变可能与CHD 的发生、发展有一定的病理联系,因此纤维蛋白原亚组份的测定具有重要的临床意义。
纤维蛋白原亚组份测定方法有两类,一类SDS-PAGE 法,其中Mills D 方法可直接用血浆进行电泳;Holm 方法需将血浆中纤维蛋白原形成纤维蛋白凝块,再用尿素溶解凝块后进行电泳。前者由于血浆中其它蛋白干扰,结果不稳定,后者可排除其它蛋白干扰,能反映有凝血功能的纤维蛋白原,并且电泳所得条带清晰,容易分辨,结果稳定,不仅能反映血浆中纤维蛋白原三个组份的比例,同时还能观察到五条弱亚组份。该类方法的参考值:HMW69.7 ±5.1 %,LMW26.5±4.8 %,LMW′3.8 ±1.8 %。第二类是利用不同的离子强度的甘氨酸溶液将总纤维蛋白原和HMW 分别沉淀,然后计算LMW。常用的是Sasaki 法,该类方法受到纤维蛋白降解产物或其它蛋白的影响,特异性较差。
纤维蛋白单体聚合功能测定
纤维蛋白原被凝血酶作用形成纤维蛋白单体,继而发生聚合反应形成凝块。观察纤维蛋白单体聚合速率(FMPV)不仅能了解纤维蛋白原分子对凝血酶的反应性,且异常时有临床价值。FMPV 降低可能与纤维蛋白原结构异常有关。测定时可用凝血酶、爬虫酶或蕲蛇毒使纤维蛋白原转变成纤维蛋白单体。用凝血酶更符合生理状况,但需要在纯体系内进行,而用爬虫酶或蕲蛇毒可避免血浆蛋白抑制酶、肝素和纤维蛋白原或纤维蛋白降解产物的影响,并可直接用0.515 ±0.154,A:0.136 ±0.030,FMPV/A:3.579±0.256。
纤维蛋白原作为急性时相蛋白和缺血性心脑血管病的危险因素的理论已被普遍接受,纤维蛋白原水平、亚组份、功能、基因多态性的研究和应用不仅为出、凝血性疾病, 而且为心脑血管疾病的防治提供一定的理论依据。