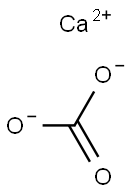
탄산칼슘
|
|
탄산칼슘 속성
- 녹는점
- 825 °C
- 끓는 점
- 800 °C
- 밀도
- 2.93 g/mL at 25 °C (lit.)
- 굴절률
- 1.6583
- 저장 조건
- Store at +5°C to +30°C.
- 용해도
- 5 M HCl: 20°C에서 0.1°M, 투명, 무색
- 물리적 상태
- 랜덤 크리스털
- Specific Gravity
- 2.93
- 색상
- 흰색-베이지색에서 약간 베이지색-회색
- 수소이온지수(pH)
- 9.91(1 mM solution);9.91(10 mM solution);9.91(100 mM solution);
- 냄새
- 냄새 없는
- pH 범위
- 8
- 수용성
- 불용성
- 최대 파장(λmax)
- λ: 260 nm Amax: ≤0.09
λ: 280 nm Amax: ≤0.06
- Merck
- 14,1657
- BRN
- 8008338
- Solubility Product Constant (Ksp)
- pKsp: 8.54
- 노출 한도
- NIOSH: TWA 10 mg/m3; TWA 5 mg/m3
- Dielectric constant
- 6.1(Ambient)
- 안정성
- 안정적인. 산, 불소, 암모늄염, 명반과 호환되지 않습니다.
- InChIKey
- VTYYLEPIZMXCLO-UHFFFAOYSA-L
- CAS 데이터베이스
- 471-34-1(CAS DataBase Reference)
- 위험 및 안전 성명
- 위험 및 사전주의 사항 (GHS)
| 위험품 표기 | Xi | ||
|---|---|---|---|
| 위험 카페고리 넘버 | 37/38-41-36/38-36 | ||
| 안전지침서 | 26-36/37/39-37/39-37 | ||
| OEB | B | ||
| OEL | TWA: 10 mg/m3 (total) | ||
| WGK 독일 | - | ||
| RTECS 번호 | FF9335000 | ||
| TSCA | Yes | ||
| HS 번호 | 28365000 | ||
| 유해 물질 데이터 | 471-34-1(Hazardous Substances Data) | ||
| 독성 | LD50 orally in Rabbit: 6450 mg/kg LD50 dermal Rat > 2000 mg/kg | ||
| 기존화학 물질 | KE-04487 |
탄산칼슘 C화학적 특성, 용도, 생산
개요
칼슘의 탄산염이다. 화학식은 CaCO3. 상온에서 흰색의 고체. 산을 만나면 이산화탄소를 내놓으면서 반응한다든가, 열을 가하면 이산화탄소를 내놓으면서 산화물로 분해되는 점 등 일반적인 탄산염의 특성을 갖고 있다.매우 흔하게 볼 수 있는 성분이다. 각종 암석에 흔하게 들어 있고, 생명체에서도 흔히 볼 수 있다. 방해석이나 아라고나이트는 순수한 탄산칼슘으로 이루어졌고, 석회석, 백악, 대리석 등에도 탄산칼슘이 많다.용도
탄산칼슘은 값도 싸고 무게도 가벼워서 이런 저런 용도로 널리 쓰인다. 건축재료로 많이 사용된다. 도로를 까는 데 쓰이는 아스팔트에 충진재로서 추가된다. 미세한 가루로 만든 탄산칼슘은 콘크리트의 충진재로 들어간다. 예전에는 탄산칼슘이 많은 석회암을 이용해서 석상 등을 만들기도 했지만, 요즘은 산성비 때문에 석회암을 건축 재료로 직접적으로 사용하지는 않는다. 산성비에 포함된 산이 탄산칼슘을 녹이기 때문이다. 용광로에서 철을 정련할 때 사용된다. 탄산칼슘에서 나온 칼슘 산화물이 철광석의 각종 불순물과 결합해서 찌꺼기로 떨어져 나가기 때문이다. 탈황 처리, 불소 제거에 사용된다. 유리 제조에 사용되어 점도를 조절한다. 타일용 접착제의 주성분이다. 마감용 실런트에도 들어간다. 각종 제품에서 충진재로 사용된다. 제지 공정에서 종이에 첨가된다. 최대 20%를 차지하기도 한다. 페인트나 플라스틱류에도 충진재로 첨가된다. 농업용 석회의 주 성분이다. 비료용은 아니고, 땅이 산성화한 것을 중화시키는 용도의 토양 개선제로 사용된다. 분필의 주재료로도 사용된다. 대표적으로는 문교 탄산칼슘 분필. 탄산칼슘은 의약품이나 식품첨가물로도 사용된다.용도
석회석 ·대리석으로서 시멘트의 주원료, 산화칼슘의 원료, 제철 ·건축재료 등의 각종 중화제로서 사용된다. 또, 호분은 백색 안료 ·수성도료에, 침강 탄산칼슘은 안료 ·도료 ·치약 등에 사용되며, 고무에도 보강제로서 배합된다.순도시험
(1) 염산불용물 : 이 품목 5g에 물 10mL를 가하여 저어 섞으면서 거품이 그칠 때까지 염산 12mL를 적가하고 다시 물을 가하여 전량을 200mL로 하고 정량용여과지로 여과하여 여과지상의 잔류물을 씻은 액이 염화물의 반응을 나타내지 아니할 때까지 열탕으로 잘 씻고 여과지와 함께 회화할 때, 그 양은 10mg 이하이어야 한다.
(2) 유리알칼리 : 이 품목 3g에 새로 끓여서 식힌 물 30mL를 가하여 3분간 흔들어 섞은 다음 여과하고 여액 20mL에 페놀프탈레인시액 2방울을 가할 때 홍색을 나타내어도 그 색은 0.1N 염산 0.2mL를 가할 때 없어져야 한다.
(3) 비소 : 이 품목을 비소시험법에 따라 시험할 때, 그 양은 4.0ppm 이하이어야 한다.
(4) 납 : 「메타인산나트륨」의 순도시험 (2)에 따라 시험한다(3.0ppm 이하).
(5) 카드뮴 : 「메타인산나트륨」의 순도시험 (3)에 따라 시험한다(1.0ppm 이하).
(6) 불소화물 : 이 품목 1g을 정밀히 달아 「구연산칼슘」의 순도시험 (8)에 따라 시험한다(50ppm 이하).
(7) 알칼리금속 및 마그네슘 : 이 품목 1g에 1N 염산 30mL를 천천히 가하여 녹이고 끓여서 이산화탄소를 날려 보내고 식힌 다음 암모니아시액으로 중화하고 수산암모늄시액 60mL를 가하여 수욕상에서 1시간 가열한다. 식힌 다음 물을 가하여 100mL로 하고 잘 저어 섞은 다음 여과하여 여액 50mL를 취하고 황산 0.5mL를 가하여 증발건고한 다음 항량으로 될 때까지 강열할 때, 그 양은 5mg 이하이어야 한다.
(8) 바륨 : 이 품목 1g을 묽은염산 15mL에 녹이고 물을 가해서 30mL로 한 다음 여과한 여액을 취하여 초산나트륨 2g, 묽은초산 1mL 및 크롬산칼륨시액 0.5mL를 가해 15분간 방치할 때, 그 액의 탁도는 바륨표준용액 0.3mL를 취해서 물을 가하여 20mL로 한 액에 대하여 위와 같이 조작을 하였을 때의 탁도 이하이어야 한다(0.03% 이하).
확인시험
이 품목 1g에 물 10mL 및 초산 7mL를 가하면 거품이 일면서 녹는다. 이 액을 끓인 다음 암모니아시액으로 중화한 액은 확인시험법 중 칼슘염의 반응을 나타낸다.
정량법
정 량 법 이 품목을 건조한 다음 약 1g을 정밀히 달아 묽은염산 10mL에 주의하여 녹이고 물을 가하여 100mL로 한다. 그 액 10mL를 취하여 이하 「수산화칼슘」의 정량법에 따라 정량한다.
0.05M 이.디.티.에이.용액 1mL = 5.004mg CaCO3
개요
Calcium carbonate occurs in nature as limestone in various forms, such as marble, chalk, and coral. It is probably the most widely-used raw material in the chemical industry. It has numerous applications, primarily to produce cement, mortars, plasters, refractories, and glass as building materials. It also is used to produce quicklime, hydrated lime and a number of calcium compounds. It is produced either as powdered or precipitated calcium carbonate. The latter consists of finer particles of greater purity and more uniform size. They also have many important commercial applications. Various grades of precipitated calcium carbonate are used in several products, such as textiles, papers, paints, plastics, adhesives, sealants, and cosmetics.
calcium carbonate block
화학적 성질
Calcium carbonate occurs in two forms—hexagonal crystal known as calcite, and orthorhombic form, aragonite. Calcite decomposes on heating at 825°C, aragonite melts at 1,339°C (at 102.5 atm). Density 2.71 g/cm3 (calcite), 2.83 g/cm3 (aragonite); insoluble in water (15mg/L at 25°C); Ksp 4.8x10–9 ; soluble in dilute mineral acids.물리적 성질
Calcium carbonate is a naturally occurring compound found in organisms and throughout the earth’s crust. After quartz, calcium carbonate, primarily in the form of calcite, is the most common mineral found in the crust. Geologically, calcium carbonate exists in several mineral forms: calcite, aragonite, and vaterite. Calcite is the most common calcium carbonate mineral, whereas vaterite is a very rare form. The different mineral forms of calcium carbonate are based on their crystalline structure. The form of calcium carbonate depends on the conditions at its formation such as temperature and pressure.출처
Calcium carbonate occurs in nature as limestone in various forms, such as marble, chalk, and coral. It is probably the most widely-used raw material in the chemical industry. It has numerous applications, primarily to produce cement, mortars, plasters, refractories, and glass as building materials. It also is used to produce quicklime, hydrated lime and a number of calcium compounds. It is produced either as powdered or precipitated calcium carbonate. The latter consists of finer particles of greater purity and more uniform size. They also have many important commercial applications. Various grades of precipitated calcium carbonate are used in several products, such as textiles, papers, paints, plastics, adhesives, sealants, and cosmetics.용도
Calcium Carbonate is the calcium salt of carbonic acid which is used as an anticaking agent and dough strengthener. it is available in varying particle sizes ranging from coarse to fine powder. it is practically insoluble in water and alcohol, but the presence of any ammonium salt or carbon dioxide increases its solubility while the presence of any alkali hydroxide reduces its solubility. it has a ph of 9–9.5. it is the primary source of lime (calcium oxide) which is made by heating limestone in a furnace. calcium carbonate is used as a filler in baking powder, for calcium enrichment, as a mild buffering agent in doughs, as a source of calcium ions in dry mix desserts, and as a neutralizer in antacids. it is also termed limestone.정의
calcium carbonate: A white solid,CaCO3, which is only sparingly solublein water. Calcium carbonatedecomposes on heating to give calciumoxide (quicklime) and carbondioxide. It occurs naturally as theminerals calcite (rhombohedral; r.d.2.71) and aragonite (rhombic; r.d.2.93). Rocks containing calcium carbonatedissolve slowly in acidifiedrainwater (containing dissolved CO2)to cause temporary hardness. In thelaboratory, calcium carbonate is precipitatedfrom limewater by carbondioxide. Calcium carbonate is used inmaking lime (calcium oxide) and isthe main raw material for theSolvay process.제조 방법
Calcium carbonate may also be produced by mixing solutions of calcium chloride and sodium carbonate. In some cases, the presence of sodium is objectionable so that the ammonium carbonate salt is preferable.주요 응용
Calcium carbonate is used as a very mild abrasive for hand polishing nickel, gold, silver, or plated ware, buttons, and similar materials.생산 방법
Calcium carbonate is obtained from natural limestone deposits. The purified compound, known as precipitated calcium carbonate, is synthesized from limestone. Limestone is calcined to calcium oxide and carbon dioxide in a kiln. The products are recombined after purification. Calcium oxide is hydrated with water to give a slurry called milk of lime, which is then carbonated by bubbling CO2 through it. The reactions involved in the process are as follows:CaCO3 CaO + CO2
CaO + H2O Ca(OH)2
Ca(OH)2+ CO2→CaCO3+ H2O
The crystal sizes required for various commercial applications may be controlled by temperature, pH, concentrations, and mixing rate.
Calcium carbonate also may be precipitated by mixing solutions of calcium chloride and sodium carbonate.
화학 반응
Calcium carbonate decomposes to calcium oxide and CO2 on heating. Treatment with dilute mineral acids produces corresponding calcium salts with liberation of CO2:CaCO3+ 2HCl →CaCl2+ H2O + CO2
In the presence of CO2 it dissolves in water with the formation of bicarbonate:
CaCO3+ H2O + CO2→Ca2++ 2HCO3 ¯
It is reduced to calcium carbide when heated with coke or anthracite in an electric furnace:
2CaCO3+ 5C→(high temperature)→2CaC2+ 3CO2
일반 설명
Calcium Carbonate (CaCO3) is a naturally found material in chalk, limestone, and marble. It is composed of three elements which include carbon, oxygen, and calcium. It is formed by reacting carbon dioxide with slaked or burnt lime. It can be used for a variety of applications ranging from industrial, food to agriculture.농업용
Calcium carbonate (CaCO3) is a naturally occurring white solid that is sparingly soluble in water. It is most commonly used to neutralize soil acidity to the required level in a process called liming.The major sources of calcium carbonate are calcitic limestone, dolomitic limestone, marl, chalk and marble. Calcium carbonate is made by passing carbon dioxide (CO2) into limewater. Pure calcium carbonate is assumed to have a 100% neutralizing value. The values of other liming materials are measured against the neutralizing value of pure calcium carbonate. Calcium carbonate, on heating, decomposes to give calcium oxide (quick lime) and carbon dioxide.
Limestone, which consists mainly of calcium carbonate, is called calcitic limestone or high calcium limestone. Limestone containing more than 10% magnesium carbonate is called dolomitic limestone or dolomite. These forms contain about 12% magnesium. Agricultural dolomitic limestone is a fine, grey to white powder of a double carbonate of calcium and magnesium with 12.8% magnesium and 17% calcium. The double carbonate is much less soluble in water than the individual carbonates.
Pharmaceutical Applications
Calcium carbonate (CaCO3) can be found in clinical applications such as antacids, but not that an excessive intake can be hazardous.A variety of calcium salts are used for clinical application, including calcium carbonate, calcium chloride, calcium phosphate, calcium lactate, calcium aspartate and calcium gluconate. Calcium carbonate is the most common and least expensive calcium supplement. It can be difficult to digest and may cause gas in some people because of the reaction of stomach HCl with the carbonate and the subsequent production of CO2.
Calcium carbonate is recommended to be taken with food, and the absorption rate in the intestine depends on the pH levels. Taking magnesium salts with it can help prevent constipation. Calcium carbonate consists of 40% Ca2+, which means that 1000 mg of the salt contains around 400 mg of Ca2+. Often, labels will only indicate the amount of Ca2+ present in each tablet and not the amount of calcium carbonate.
Safety
Calcium carbonate is mainly used in oral pharmaceutical formulations and is generally regarded as a nontoxic material. However, calcium carbonate administered orally may cause constipation and flatulence. Consumption of large quantities (4–60 g daily) may also result in hypercalcemia or renal impairment. Therapeutically, oral doses of up to about 1.5 g are employed as an antacid. In the treatment of hyperphosphatemia in patients with chronic renal failure, oral daily doses of 2.5–17 g have been used. Calcium carbonate may interfere with the absorption of other drugs from the gastrointestinal tract if administered concomitantly.LD50 (rat, oral): 6.45 g/kg
저장
Calcium carbonate is stable and should be stored in a well-closed container in a cool, dry place.Structure and conformation
The space lattice of CaCO3 belongs to the triagonal system, and the sodium nitric acid structure has a space group of D63d. It isarhombohedron crystal, with a basis comprising two molecules, and it has a lattice constant of a=0.636 nm, a=46°6'. Ca1 positions (1/4, 1/4, 1/4), Ca2 (3/4, 3/4, 3/4), C3 (0, 0, 0) and C4 (1/2, 1/2, 1/2), andCtakes the middle of Ca–Ca. The O atom positions the corner of the triangle, the plane of which is perpendicular to the optical axis, Ca–C–Ca–. This includes C and O3, as C4 shift position by 60° with the O3 of C3. The behavior of CO 2K 3 is different for light oscillating perpendicularly to the optical axis (O-ray) and light oscillating parallel to the axis (E-ray), which is the origin of the uniaxial negative crystal.비 호환성
Incompatible with acids and ammonium salts.Regulatory Status
GRAS listed. Accepted for use as a food additive in Europe. Included in the FDA Inactive Ingredients Database (buccal chewing gum, oral capsules and tablets; otic solutions; respiratory inhalation solutions). Included in nonparenteral medicines licensed in the UK. Included in the Canadian List of Acceptable Non-medicinal Ingredients.탄산칼슘 준비 용품 및 원자재
원자재
준비 용품
탄산칼슘 공급 업체
| 공급자 | 전화 | 이메일 | 국가 | 제품 수 | 이점 |
|---|---|---|---|---|---|
| HEBEI SHENGSUAN CHEMICAL INDUSTRY CO.,LTD | +8615383190639 |
admin@86-ss.com | China | 1000 | 58 |
| Auschemicals Pty Ltd | +61406202619 |
info@auschemicals.com | Australia | 431 | 58 |
| Anhui Royal Chemical Co., Ltd. | +86-25-86655873 +8613962173137 |
marketing@royal-chem.com | China | 189 | 55 |
| Shaanxi Dideu Medichem Co. Ltd | +86-29-81148696 +86-15536356810 |
1022@dideu.com | China | 3878 | 58 |
| Hebei Chuanghai Biotechnology Co,.LTD | +86-13131129325 |
sales1@chuanghaibio.com | China | 5895 | 58 |
| Shaanxi Haibo Biotechnology Co., Ltd | +undefined18602966907 |
qinhe02@xaltbio.com | China | 1000 | 58 |
| Henan Fengda Chemical Co., Ltd | +86-371-86557731 +86-13613820652 |
info@fdachem.com | China | 20291 | 58 |
| Shandong Juchuang Chemical Co., LTD | +undefined15030412209 |
admin@juchuangchem.com | China | 387 | 58 |
| Shaanxi TNJONE Pharmaceutical Co., Ltd | +8618740459177 |
sarah@tnjone.com | China | 1143 | 58 |
| Hebei Zhuanglai Chemical Trading Co.,Ltd | +8613343047651 |
admin@zlchemi.com | China | 3002 | 58 |